Dung dịch HF được dùng để khắc chữ vẽ hình lên thủy tinh nhờ phản ứng với chất nào sau đây?
Acid hydrofloric acid có khả năng hoàn tan silicon dioxide nên được sử dụng để khắc các chi tiết lên thủy tinh theo phản ứng:
HF + SiO2 → SiF4 + 2H2O
Dung dịch HF được dùng để khắc chữ vẽ hình lên thủy tinh nhờ phản ứng với chất nào sau đây?
Acid hydrofloric acid có khả năng hoàn tan silicon dioxide nên được sử dụng để khắc các chi tiết lên thủy tinh theo phản ứng:
HF + SiO2 → SiF4 + 2H2O
Cho các phát biểu sau:
(a) Quá trình chưng cất rượu, C2H5OH bay trước H2O mặc dù khối lượng phân tử C2H5OH lớn hơn khác nhiều khối lượng phân tử H2O.
(b) Khối lượng phân tử càng lớn thì nhiệt độ nóng chảy, nhiệt độ sôi càng thấp.
(c) Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau, ngay cả ở thể hơi, thành một cụm phân tử.
(d) Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất, nhưng ở mức độ ảnh hưởng mạnh hơn so với liên kết hydrogen.
Trong các phát biểu trên, số phát biểu đúng là
Phát biểu đúng: (a), (c).
Phát biểu (b) không đúng, vì: Khối lượng phân tử càng lớn thì nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
Phát biểu (d) không đúng, vì: Tương tác Van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất, nhưng ở mức độ ảnh hưởng yếu hơn so với liên kết hydrogen.
Cho phản ứng sau: 2H2(g) + O2(g) → 2H2O(g) ![]() = –483,64 kJ. Phát biểu nào sau đây đúng?
= –483,64 kJ. Phát biểu nào sau đây đúng?
- Phản ứng có = –483,64 kJ < 0 ⇒ Phản ứng tỏa nhiệt.
- Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
⇒ Phát biểu đúng là: Nhiệt tạo thành chuẩn của H2O là –241,82 kJ/mol.
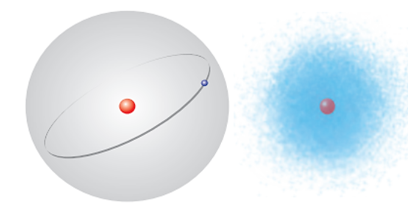
Trong lịch sử các thuyết về mô hình nguyên tử có mô hình hành tinh nguyên tử (mô hình Rutherford – Bohr) và mô hình hiện đại của nguyên tử.
|
Mô hình (1) |
Mô hình (2) |
a) Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử. Sai||Đúng
b) Giống nhau giữa mô hình (1) và (2) là nguyên tử lớp vỏ gồm các electron mang điện tích âm quay xung quanh hạt nhân. Đúng||Sai
c) Theo mô hình (1) electron chuyển động rất nhanh trong cả khu vực không gian xung quanh hạt nhân không theo quỹ đạo cố định. Sai||Đúng
d) Theo mô hình (2), xác suất tìm thấy electron lớn nhất là ở trong các orbital nguyên tử (xác suất tìm thấy khoảng 90%). Đúng||Sai
Trong lịch sử các thuyết về mô hình nguyên tử có mô hình hành tinh nguyên tử (mô hình Rutherford – Bohr) và mô hình hiện đại của nguyên tử.

|
Mô hình (1) |
Mô hình (2) |
a) Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử. Sai||Đúng
b) Giống nhau giữa mô hình (1) và (2) là nguyên tử lớp vỏ gồm các electron mang điện tích âm quay xung quanh hạt nhân. Đúng||Sai
c) Theo mô hình (1) electron chuyển động rất nhanh trong cả khu vực không gian xung quanh hạt nhân không theo quỹ đạo cố định. Sai||Đúng
d) Theo mô hình (2), xác suất tìm thấy electron lớn nhất là ở trong các orbital nguyên tử (xác suất tìm thấy khoảng 90%). Đúng||Sai
a) Sai vì
Với nguyên tử hydrogen,
Mô hình (1) là mô hình nguyên tử theo Rutherford – Bohr, mô hình (2) là mô hình nguyên tử hiện đại.
b) đúng
c) sai
Vì
Theo mô hình (1) là mô hình Rutherford – Bohr: Electron quay xung quanh hạt nhân theo các quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
d) đúng
Theo mô hình (2), xác suất tìm thấy electron lớn nhất là ở trong các orbital nguyên tử (xác suất tìm thấy khoảng 90%).
Cho phản ứng: 2NO + O2 ![]() 2NO2
2NO2
Biết nồng độ ban đầu của khí NO là 0,5M và khí O2 là 0,2M. Hằng số tốc độ phản ứng là 0,3. Tốc độ phản ứng khi nồng độ khí NO giảm đi 0,2M là?
2NO + O2 2NO2
Theo tỉ lệ phản ứng, khi nồng độ khí NO giảm đi 0,2M thì nồng độ khí O2 giảm đi 0,1M.
⇒ Nồng độ còn lại của khí NO là: 0,5 - 0,2 = 0,3M
Nồng độ còn lại của khí O2 là: 0,2 - 0,1 = 0,1M
Tốc độ phản ứng: v = = 2,7.10−3 (mol/L.s)
Hòa tan 4,59 gam Al bằng dung dịch HNO3 dư thu được hỗn hợp khí NO và N2O có tỉ khối hơi đối với hydrogen bằng 16,75 (ngoài ra không có sản phẩm khử nào khác). Thể tích (đktc) NO và N2O thu được lần lượt là:
nAl = 0,17 (mol).
Gọi nNO = x mol, nN2O = y mol
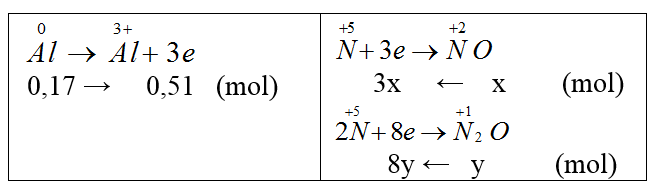
Bảo toàn electron: 3x + 8y = 0,51 (1)
Từ (1) và (2) ta có: x = 0,09 (mol); y = 0,03 (mol)
VNO = 0,09.22,4 = 2,016 (l),
VN2O = 0,03.22,4 = 0,672 (l)
Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 3, 11, 19. Phát biểu nào sau đây là sai?
ZX = 3, X thuộc chu kì 2, nhóm IA.
ZY = 11, Y thuộc chu kì 3, nhóm IA.
ZZ = 19, Z thuộc chu kì 4, nhóm IA.
Nhận đinh:
“Các nguyên tố này đều là phi kim mạnh nhất trong chu kì” ⇒ sai vì nguyên tố thuộc nhóm IA là các kim loại mạnh nhất trong chu kì.
“Các nguyên tố này không cùng thuộc một chu kì” ⇒ đúng vì X thuộc chu kì 2, Y thuộc chu kì 3, Z thuộc chu kì 4.
X(OH)2 < Y(OH)2 < Z(OH)2: ⇒ đúng vì trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, tính base của các hydroxide tương ứng tăng dần.
“Thứ tự tăng dần độ âm điện: X < Y < Z” ⇒ đúng vì trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân độ âm điện của các nguyên tố nhìn chung giảm dần.
Mối quan hệ giữa tốc độ phản ứng thuận vt và tốc độ phản ứng nghịch vn ở trạng thái cân bằng được biểu diễn như thế nào?
Cân bằng hóa học là khi vt = vn.
Cho phương trình nhiệt hoá học của phản ứng.
2H2(g) + O2(g) → 2H2O(l) ![]() = - 571,68 kJ
= - 571,68 kJ
Phản ứng trên là phản ứng
Phản ứng có < 0
Là phản ứng tỏa nhiệt.
Tiến hành thí nghiệm:
- Cho cùng một lượng (khoảng 2 g) đá vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào bình tam giác (2).
- Rót 20 ml dung dịch HCl 0,5M vào mỗi bình.
Nhận xét nào sau đây là đúng?
Phương trình hóa học: CaCO3 + 2HCl CaCl2 + CO2 + H2O.
Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
Phản ứng trong bình (2) có tốc độ thoát khí nhanh hơn.
Cho m gam Mg tác dụng vừa đủ với dung dịch H2SO4 đặc đến khi phản ứng xảy ra hoàn toàn thu được dung dịch X và 2,479 lít khí SO2 (sản phẩm khử duy nhất S+6, ở đkc). Giá trị của m là
nSO2 = 0,1 (mol)
Quá trình nhường electron:
Quá trình nhận electron:
Áp dụng bảo toàn electron:
2nMg = 2nSO2 ⇒ nMg = nSO2 = 0,1 mol
⇒ mMg = 0,1.24 = 2,4 gam
Hợp chất nào sau đây lưu huỳnh có số oxi hóa +6?
Gọi số oxi hóa của S trong mỗi hợp chất là x. Áp dụng quy tắc xác định số oxi hóa của nguyên tử các nguyên tố ta có:
- H2S: x + (+1).2 = 0 ⇒ x = –2
- Na2SO4: 2.(+1) + x + (–2).4 = 0 ⇒ x = +6
- SO2: x + (–2).2 = 0 ⇒ x = +4
- Na2SO3: (+1).2 + x + (–2).3 = 0 ⇒ x = +4
Vậy S có số oxi hóa +6 trong hợp chất Na2SO4.
Chlorine hóa hoàn toàn 3,92 gam kim loại X thu được 11,375 gam muối clorua tương ứng. Để hòa tan vừa đủ 9,2 gam hỗn hợp gồm kim loại X và một oxide của nó cần dùng 160 mL dung dịch HCl 2M, còn nếu cho luồng khí H2 dư đi qua 9,2 gam hỗn hợp trên thì sau phản ứng thu được 7,28 gam chất rắn Y. Công thức của oxide kim loại X là
Phương trình tổng quát
2X + nCl2 → 2XCln
nX = nXCl2
| n | 1 | 2 | 3 |
| M | 56 (Fe) |
Vậy X là Fe
Fe + 2HCl → FeCl2 + H2
a → 2a
FexOy + 2yHCl → FexCl2y + yH2O
b → 2by
FexOy + yH2 xFe + yH2O
b → by
Goi a b lần lượt là số mol của Fe và FexOy trong 9,2 gam hỗn hợp
nFe = a ⇒ nHCl = 2a
nFexOy = b ⇒ nHCl = 2by
nHCl = 0,16.2 = 3,2 mol
⇒ 2a + 2by = 3,2 ⇒ a + by = 0,16 (1)
⇒ 56a + 56bx + 16by = 9,2 (2)
Chất rắn X là Fe
nFexOy = b ⇒ nFe sinh ra là bx
⇒ 56a + 56bx = 7,28 (3)
Từ (1) (2) và (3) ta có hệ
⇒
Vậy công thức oxit cần tìm là Fe3O4
Nung nóng 15,36 gam copper (Cu) trong bình đựng khí chlorine (Cl2), sau một thời gian thu được 24,3 gam copper chloride (CuCl2). Hiệu suất của phản ứng là
nCuCl2 = 24,3 : 135 = 0,18 mol
Phương trình phản ứng:
Cu + Cl2 CuCl2
0,18 ← 0,18
mCu thực tế = 0,18.64 = 11,52 gam
Hiệu suất phản ứng:
H = 11,52: 15,36 .100% = 75%
Vì sao khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò?
Khi nung vôi người ta phải xếp đá vôi lẫn với than trong lò vì:
- Phản ứng đốt cháy than là phản ứng tỏa nhiệt.
- Phản ứng nung vôi là phản ứng thu nhiệt.
- Nhiệt tỏa ra trong quá trình đốt cháy than sẽ cung cấp cho quá trình nung vôi.
Phát biểu nào sau đây là không đúng?
Các phản ứng xảy ra ở nhiệt độ phòng thường là phản ứng tỏa nhiệt.
Nước dễ dàng dâng lên trong mao quản của rễ cây để vận chuyển lên thân và lá cây, đó là do có
Do có liên kết hydrogen nước dễ dàng dâng lên trong mao quản của rễ cây để vận chuyển lên thân và lá cây.
Biểu thức tính biến thiên enthalpy chuẩn của phản ứng: 2H2(g) + O2(g) ![]() 2H2O(g) theo năng lượng liên kết là:
2H2O(g) theo năng lượng liên kết là:
Biểu thức tính biến thiên enthalpy chuẩn của phản ứng: 2H2 (g) + O2 (g) 2H2O (g) theo năng lượng liên kết là:
= 2Eb(H-H) + Eb(O=O) – 4Eb(O-H).
Ở điều kiện thường, hydrogen chloride có tính chất vật lý nào sau đây?
Ở điều kiện thường, hydrogen chloride là chất khí không màu, mùi xốc, nặng hơn không khí, khí hydrogen chloride tan nhiều trong nước tạo thành dung dịch acid.
Cho phương trình phản ứng Zn(r) + CuSO4(aq) → ZnSO4(aq) + Cu(s) ![]() Và các phát biểu sau:
Và các phát biểu sau:
a) Zn bị oxi hóa. Đúng||Sai
b) Phản ứng trên tỏa nhiệt. Đúng||Sai
c) Biến thiên enthalpy của phản ứng tạo thành 3,84g Cu là +12,6 kJ. Sai||Đúng
d) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên. Đúng||Sai
Cho phương trình phản ứng Zn(r) + CuSO4(aq) → ZnSO4(aq) + Cu(s) Và các phát biểu sau:
a) Zn bị oxi hóa. Đúng||Sai
b) Phản ứng trên tỏa nhiệt. Đúng||Sai
c) Biến thiên enthalpy của phản ứng tạo thành 3,84g Cu là +12,6 kJ. Sai||Đúng
d) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên. Đúng||Sai
Zn(r) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
+) Số oxi hóa của Zn tăng ⇒ Zn là chất khử (chất bị oxi hóa)
+) ⇒ Phản ứng tỏa nhiệt
+) Biến thiên enthalpy của phản ứng tạo thành 1 mol Cu ~ 64 gam Cu là
⇒ Biến thiên enthalpy của phản ứng tạo thành 3,84 g Cu là:
+) Phản ứng tỏa nhiệt ⇒ Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên.
Vậy
a) Đúng
b) Đúng
c) Sai
d) Đúng
Nguyên tố Y ở chu kì 3, nhóm IA trong bảng tuần hoàn. Tính chất hóa học cơ bản của Y là:
Y ở chu kì 3, nhóm IA trong bảng tuần hoàn ⇒ Y là kim loại điển hình.
Phản ứng tổng hợp glucose của cây xanh có phương trình hóa học:
6CO2 + 6H2O + 675 kcal → C6H12O6 + 6O2
Giả sử trong một phút, mỗi cm2 lá xanh hấp thụ 0,6 cal của năng lượng mặt trời và chỉ có 15% được dùng vào việc tổng hợp glucose. Nếu một cây có 20 lá xanh, với diện tích trung bình của mỗi lá là 12cm2. Tính thời gian cần thiết để tổng hợp được 0,36 gam glucose?
Tổng diện tích: S = 20.12 = 240 cm2
Trong 1 phút, tổng năng lượng hấp thụ được = 240.0,6 = 144 cal.
Trong đó, năng lượng hữu ích = 144.0,15 = 21,6 cal
nC6H12O6 = 0,36 : 180 = 0,002 mol
Ta có phương trình:
6CO2 + 6H2O + 675 kcal → C6H12O6 + 6O2
1,35 ← 0,002
Thời gian cần thiết = 1,35.1000:21,6 = 62,5 phút = 1 giờ 2 phút 30 giây
Rong biển chứa nhiều nguyên tố
Rong biển chứa nguyên tố iodine.
Nguyên tử carbon vừa có khả năng thể hiện tính oxi hóa, vừa có khả năng thể hiện tính khử trong chất nào sau đây?
Xét số oxi hóa của C trong các hợp chất
C0, C+4O2, CaC+4O3, C-4H4.
C đơn chất có số oxi hóa bằng 0, là số oxi hóa trung gian của C, số oxi hóa này có thể tăng hoặc giảm trong phản ứng oxi hóa khử.
⇒ Nguyên tử carbon vừa có khả năng thể hiện tính oxi hóa, vừa có khả năng thể hiện tính khử trong C đơn chất.
Đặc điểm nào dưới đây không phải đặc điểm chung của các nguyên tố halogen (F, Cl, Br, I)?
Trong tất cả các hợp chất, F chỉ có số oxi hóa -1 do F có độ âm điện lớn nhất.
Các nguyên tố halogen khác ngoài số oxi hóa -1 còn có các số oxi hóa +1; +3; +5; +7
Cho phản ứng hóa học sau:
I2 (s) + KI (aq) → KI3 (aq)
Vai trò của KI trong phản ứng trên là gì?
Có thể nhận thấy potassium không thay đổi số oxi hóa (+1 trong các hợp chất).
Như vậy, trong phản ứng này không có sự thay đổi số oxi hóa của các nguyên tố, do đó không phải là phản ứng oxi hóa – khử.
Cho 39,8 gam hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp) vào dung dịch AgNO3 dư thì thu được 71,675 gam kết tủa. Biết cả NaX và NaY đều tạo kết tủa với AgNO3. Xác định công thức của hai muối là:
Đặt hỗn hợp (NaX, NaY) tương đương với NaM
NaM + AgNO3 → AgM↓+NaNO3
Ta có
⇒ X,Y lần lượt là Br (80) và I (127)
Vậy 2 muối cần tìm là: NaBr và NaI
Hydrogen halide là
Hydrogen halide là hợp chất của hydrogen với halogen (HX).
Dấu hiệu để nhận ra phản ứng là phản ứng oxi hóa – khử dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
Dấu hiệu để nhận ra phản ứng là phản ứng oxi hóa – khử dựa trên sự thay đổi số oxi hóa.
Cho các phản ứng sau:
(1) A + HCl → MnCl2 + B↑ + H2O.
(2) B + C → nước Javel.
(3) C + HCl → D + H2O.
(4) D + H2O ![]() C + B↑+ E↑.
C + B↑+ E↑.
Chất Khí E là chất nào sau đây?
(1) MnO2 + HCl → MnCl2 + Cl2 (B) + H2O.
(2) Cl2 + 2NaOH (C) → NaCl + NaClO + H2O.
(3) NaOH + HCl → NaCl (D) + H2O.
(4) 2NaCl + 2H2O 2NaOH + Cl2 + H2 (E).
Phản ứng nào sau đây chứng tỏ HCl có tính khử?
HCl có tính khử.
HCl có tính oxi hóa.
HCl không có tính khử và không có tính oxi hóa.
HCl không có tính khử và không có tính oxi hóa.
Các phản ứng khác nhau thì
Các phản ứng khác nhau xảy ra với tốc độ khác nhau, có phản ứng xảy ra nhanh, có phản ứng xảy ra chậm.
Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam CH4(g) để cung cấp nhiệt cho phản ứng tạo 0,5 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
- Khi đốt cháy 1 mol CH4 tỏa ra 890,36 kJ
- Để tạo thành 1 mol CaO bằng cách nung CaCO3 cần 178,29 kJ
Để tạo thành 0,5 mol CaO bằng cách nung CaCO3 cần 89,145 kJ
Số mol CH4 cần dùng để đốt cháy là: 89,145 : 890,36 = 0,1 mol
Số gam CH4 cần dùng để đốt cháy là: 0,1.16 = 1,6 (gam)
Nhúng một thanh sắt vào dung dịch Cu(NO3)2 một thời gian thấy khối lượng sắt tăng 1,6 gam. Khối lượng sắt đã bị hòa tan là
Phương trình hóa học:
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓
Gọi nFe phản ứng = a mol nCu = a mol
Ta có:
mtăng = mCu – mFe 1,6 = 64a – 56a
a = 0,2 mol
mFe = 0,2.56 = 11,2 gam
Tính oxi hóa của Br2
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Khi cho potassium bromide rắn phản ứng với sulfuric acid đặc thu được khí hydrogen bromide. Sai || Đúng
(b) Hydrofluoric acid không nguy hiểm vì nó là một acid yếu. Sai || Đúng
(c) Hydrofluoric acid được dùng để khắc lên thủy tinh. Đúng || Sai
(d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X. Sai || Đúng
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Khi cho potassium bromide rắn phản ứng với sulfuric acid đặc thu được khí hydrogen bromide. Sai || Đúng
(b) Hydrofluoric acid không nguy hiểm vì nó là một acid yếu. Sai || Đúng
(c) Hydrofluoric acid được dùng để khắc lên thủy tinh. Đúng || Sai
(d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X. Sai || Đúng
(a) sai vì:
2KBr(s) + 3H2S4(l) → 2KHSO4(s) + Br2(g) + SO2(g) + 2H2O(g)
Như vậy tạo ra khí SO2 và hơi Br2.
(b) sai vì HF có độc tính rất mạnh.
(c) đúng vì hydrofluoric acid có phản ứng với silicon dioxide nên được dùng để khắc lên thủy tinh:
SiO2 + 4HF → SiF4 + 2H2O
(d) sai vì ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do giữa các phân tử hydrogen fluoride còn tạo liên kết hydrogen với nhau.
Cho sơ đồ chuyển hóa nitrogen như sau:
N2 ![]() NO
NO ![]() NO2
NO2 ![]() HNO3
HNO3 ![]() Cu(NO3)2
Cu(NO3)2 ![]() NO2
NO2
Có bao nhiêu phản ứng oxi hóa - khử ở sơ đồ trên?
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
⇒ Các phản ứng oxi hóa khử là:
N2 + O2 2NO
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
2Cu(NO3)2 2CuO + 4NO2 + O2
Hoà tan khí Cl2 vào dung dịch KOH loãng, nguội, dư, thu được có các chất thuộc dãy nào dưới đây?
Ở nhiệt độ thường:
Cl2 + KOH KCl + KClO + H2O
Sản phẩm sau phản ứng có cả KOH dư.
Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa - khử?
Xác định sự thay đổi số oxi hóa của các nguyên tố
Phản ứng Fe + S → FeS là phản ứng oxi hóa – khử, do có sự thay đổi số oxi hóa của một số nguyên tố sau phản ứng.
Đặc điểm nào dưới đây không phải là đặc điểm chung của các nguyên tố halogen?
Đặc điểm không phải là đặc điểm chung cho các nguyên tố halogen (F, Cl, Br, I) là: Chỉ có số oxi hóa -1 trong các hợp chất.
