Số oxi hóa của Na, Mg2+, Al3+ lần lượt là:
Dựa vào quy tắc xác định số oxi hóa, số oxi hóa của sodium, magnesium, aluminium trong Na, Mg2+, Al3+ lần lượt 0, +2, +3.
Số oxi hóa của Na, Mg2+, Al3+ lần lượt là:
Dựa vào quy tắc xác định số oxi hóa, số oxi hóa của sodium, magnesium, aluminium trong Na, Mg2+, Al3+ lần lượt 0, +2, +3.
Cho MnO2 tác dụng với dung dịch HCl, toàn bộ khí sinh ra được hấp thụ hết vào dung dịch NaOH đặc, nóng tạo ra dung dịch X. Trong dung dịch X có những muối nào sau đây ?
Các phương trình hóa học xảy ra:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
3Cl2 + 6NaOH 5NaCl + NaClO3 + 3H2O
Các muối có trong dung dịch X là: NaCl, NaClO3.
Ở phản ứng nào sau đây NH3 không đóng vai trò chất khử?
- Ở các phản ứng:
4NH3 + 5O2 4NO + 6H2O;
2NH3 + 3Cl2 N2 + 6HCl;
NH3 + 3CuO 3Cu + N2 + 3H2O
NH3 có số oxi hóa tăng NH3 đóng vai trò chất khử.
- Ở phản ứng 2NH3 + H2O2 + MnSO4 MnO2 + (NH4)2SO4 đóng vai trò là môi trường.
Tính biến thiên enthalpy chuẩn của phản ứng:
C4H10(g) → C2H4(g) + C2H6(g)
Biết Eb(H-H) = 436 kJ/mol, Eb(C-H) = 418 kJ/mol, Eb(C-C) = 346 kJ/mol, Eb(C=C) = 612 kJ/mol.
= 3Eb(C−C) + 10Eb(C−H) − Eb(C=C) − 4Eb(C−H) − Eb(C−C) − 6Eb(C−H)
= 3.346 + 10.418 − 612 – 4.418 – 346 – 6.418
= 80 kJ
Cho biết phản ứng tạo thành 2 mol HCl (g) ở điều kiện chuẩn tỏa ra 184,62 kJ:
H2 (g) + Cl2 (g)⟶ 2HCl (g) (*)
Phát biểu nào dưới đây là sai?
(1) Enthalpy tạo thành chuẩn của HCl (g) là − 184,62 kJ/mol.
(2) Biến thiên enthalpy chuẩn của phản ứng (*) là − 184,62 kJ.
(3) Enthalpy tạo thành chuẩn của HCl (g) là – 92,31 kJ/mol.
(4) Biến thiên enthalpy chuẩn của phản ứng (*) là 184,62 kJ.
(1) Enthalpy tạo thành chuẩn của HCl (g) là − 184,62 kJ/mol.
⇒ sai vì − 184,62 kJ/mol là nhiệt tạo thành của 2 mol HCl (g).
(2) Biến thiên enthalpy chuẩn của phản ứng (*) là − 184,62 kJ
⇒ đúng vì biến thiên enthalpy chuẩn của phản ứng là lượng nhiệt kèm theo của phản ứng đó trong điều kiện chuẩn mà phản ứng tỏa nhiệt nên < 0.
(3) Enthalpy tạo thành chuẩn của HCl (g) là – 92,31 kJ/mol.
⇒ đúng.
(4) Biến thiên enthalpy chuẩn của phản ứng (*) là 184,62 kJ.
⇒ sai vì phản ứng tỏa nhiệt nên < 0.
Phát biểu nào sau đây là sai?
Từ HCl đến HI, nhiệt độ sôi tăng do:
- Lực tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ![]() = –890,3 kJ
= –890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là: –393,5 kJ/mol; –285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
=
–
⇒ =
(CO2(g)) + 2.
(H2O(l)) –
(CH4(g)) – 2.
(O2(g))
⇒ (CH4(g)) = –393,5 + 2.(–285,8) – (–890,3)
⇔ (CH4(g)) = –74,8 (kJ/mol)
Có một hỗn hợp KF, KBr, KI. Thổi một luồng khí Cl2 vào dung dịch cho đến dư. Sản phẩm nào sau đây được tạo thành?
Phát biểu nào sau đây là đúng?
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L–1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
Vì sao HF có nhiệt độ sôi cao hơn hẳn so với HCI, HBr, HI.
Liên kết hydrogen mạnh mẽ hơn rất nhiều so với tương tác van der Waals
Giữa các phân tử hydrogen fluoride (HF) có liên kết hydrogen:
Giữa các phân tử HCl cũng như HBr và HI không có liên kết hydrogen.
Điều này ảnh hưởng đến nhiệt độ sôi của HF cao hơn hẳn so với HCl, HBr, HI.
Nguyên tố nào sau đây không thuộc nhóm halogen?
Nhóm VIIA (nhóm halogen) trong bảng tuần hoàn gồm 6 nguyên tố: flourine (F), chlorine (Cl), bromine (Br), iodine (I), astatine (At) và tennessine (Ts). Bốn nguyên tố F, Cl, Br và I tồn tại trong tự nhiên, còn At và Ts là các nguyên tố phóng xạ.
Nguyên tố sulfur không thuộc nhóm halogen.
Phản ứng nhiệt phân hoàn toàn 1 mol Cu(OH)2, tạo thành 1 mol CuO và 1 mol H2O, thu vào nhiệt lượng 9,0 kJ. Phương trình nhiệt hóa học nào sau đây biểu diễn đúng?
Ta có phản ứng thu nhiệt nên ∆rHo298 > 0 và là phản ứng nhiệt phân Phương trình nhiệt hóa học đúng là:
Cu(OH)2(s) CuO(s) + H2O(l) ∆rHo298 = +9,0kJ.
Thể tích khí Cl2 (ở điều kiện chuẩn) vừa đủ để tác dụng hết với dung dịch KI thu được 2,54 gam I2 là
Cl2 + 2KI → I2 + 2KCl
VChlorine = 0,01.24,79 = 0,2479 L = 247,9 mL.
Từ F2 đến I2
Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
- Tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
Trong phòng thí nghiệm, nước Gia-ven được điều chế bằng cách
Chlorine phản ứng với dung dịch sodium hydroxide ở điều kiện thường, tạo thành nước Javel (Gia-ven):
Cl2 + NaOH → NaCl + NaClO + H2O
Hệ số nhiệt độ của một phản ứng là 4. Ở toC tốc độ của phản ứng đo được là 5.10-3 mol.L-1.s-1; còn ở 150oC tốc độ của phản ứng đo được là 3,215.10-4 mol.L-1.s-1. Giá trị của t là
Ta có biểu thức:
Cho phản ứng nhiệt nhôm sau:
2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)
Biết nhiệt tạo thành, nhiệt dung của các chất (nhiệt lượng cần cung cấp để 1 kg chất đó tăng lên 1 độ) được cho trong bảng sau:
|
Chất |
|
C (J/g.K) |
Chất |
|
C (J/g.K) |
|
Al |
0 |
Al2O3 |
-1669,74 |
0,84 |
|
|
Fe2O3 |
–822,4 |
Fe |
0 |
0,67 |
Giả thiết phản ứng xảy ra vừa đủ, hiệu suất 100%; nhiệt độ ban đầu là 25oC; nhiệt lượng tỏa ra bị thất thoát ngoài môi trường là 50%. Tính nhiệt độ đạt được trong lò phản ứng nhiệt nhôm.
Xét phản ứng giữa 2 mol Al với 1 mol Fe2O3 tạo 1 mol Al2O3 và 2 mol Fe
ΔrHo298 = -1669,74 + 2.0 – 2.0 – ( –822,4) = -847,34 kJ
Nhiệt dung của phẩm: C = 102.0,84 + 56.2.0,67 = 160,72 (J/K)
Nhiệt độ đạt được là: (25+ 273) + 2636 = 2934K
Phát biểu nào sau đây không đúng?
Chất nào dưới đây có ![]()
![]() 0?
0?
Enthalpy tạo thành chuẩn của các đơn chất bền nhất bằng 0.
NH3 là hợp chất
0
Dãy gồm các chất có tính base tăng dần là:
Các nguyên tố Na, Mg, Al thuộc cùng chu kỳ, được xếp lần lượt theo chiều tăng của điện tích hạt nhân.
Lại có, trong một chu kì theo chiều tăng của điện tích hạt nhân tính base của oxide tương ứng giảm dần.
⇒ Dãy gồm các chất có tính base tăng dần là Al(OH)3, Mg(OH)2, NaOH.
Hệ số tối giản của các chất trong phản ứng: FeS2 + HNO3 ![]() Fe(NO3)3 + H2SO4 + NO
Fe(NO3)3 + H2SO4 + NO![]() lần lượt là:
lần lượt là:
Xét cả phân tử FeS2 có số oxi hóa là 0
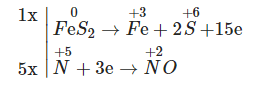
Phương trình phản ứng cân bằng:
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO↑ + 2H2O
Số oxi hóa của N trong ion NO3- là
Trong ion NO3-: x + 3.(-2) = -1 ⇒ x = 5
⇒ N có số oxi hóa là +5 trong hợp chất NO3-
Nhận định nào dưới đây đúng?
Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Hoà tan hoàn toàn 3,25 gam kim loại M hóa trị II trong dung dịch HNO3 dư thu được khí 2,24 lít khí NO2 ở đktc (sản phẩm khử duy nhất) và dung dịch muối nitrat. M là kim loại nào dưới đây?
nNO2 = 0,1 mol
Gọi x là số mol của kim loại M hóa trị II.
Quá trình nhường e M0 → M+2 + 2e x → 2x | Quá trình nhận e N+5 + 1e → N+4 0,1 ← 0,1 |
Áp dụng định luật bảo toàn e ta có
2x = 0,1 => x = 0,05 mol
=> MM = 3,25:0,05 = 65 (Zn)
Cho phản ứng: 2KOH + Cl2 → KClO + KCl + H2O. Vai trò của Cl2 trong phản ứng trên là gì?
2KOH + Cl02 → KCl+1O + KCl-1 + H2O
Cl2 vừa có tính oxi hóa vừa có tính khử.
Cho 16,2 gam kim loại M tác dụng với O2 thu được 25,8 gam chất rắn X. Hoà tan hoàn toàn X bằng dung dịch H2SO4 đặc nóng, thu được 7,437 lít khí SO2 (đktc). Kim loại M là:
nSO2 = 0,3 mol
Quy đổi hỗn hợp thành:
- Quá trình nhường electron:
- Quá trình nhận electron:
Áp dụng định luật bảo toàn electron ta có:
a.n = 0,6.2 + 0,3.2
n = 3, M = 27 thỏa mãn
Vậy kim loại M là aluminium (Al).
Cho phương trình nhiệt hóa học sau:
H2 (g) + I2 (g) → 2HI(g) ∆H = +11,3 kJ.
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
∆H = +11,3 kJ > 0 ⇒ phản ứng thu nhiệt.
phản ứng thu nhiệt nên tổng nhiệt cần cung cấp để phá vỡ liên kết lớn hơn nhiệt giải phóng khi tạo sản phẩm.
Phân tử H2 và I2 có liên kết bền hơn HI, nghĩa là mức năng lượng thấp hơn.
Không nói về sự trao đổi năng lượng của phản ứng.
Cho sơ đồ chuyển hóa nitrogen như sau:
N2 ![]() NO
NO ![]() NO2
NO2 ![]() HNO3
HNO3 ![]() Cu(NO3)2
Cu(NO3)2 ![]() NO2
NO2
Có bao nhiêu phản ứng oxi hóa - khử ở sơ đồ trên?
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
⇒ Các phản ứng oxi hóa khử là:
N2 + O2 2NO
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
2Cu(NO3)2 2CuO + 4NO2 + O2
Cho phản ứng: 4P + 5O2 ⟶ 2P2O5
Quá trình oxi hóa là
Quá trình oxi hóa là quá trình chất khử nhường electron.
Vậy quá trình oxi hóa của phản ứng trên là
Phát biểu nào sau đây đúng?
Các electron trên cùng một lớp có năng lượng gần bằng nhau, trên cùng một phân lớp có năng lượng bằng nhau
Lớp M (n = 3) có số electron tối đa bằng 2.32 =18 electron
Theo trình tự sắp xếp, lớp K (n = 1) là lớp gần hạt nhân nhất. Năng lượng của electron trên lớp này là thấp nhất
Hydrohalic acid có tính acid mạnh nhất là
Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid.
Nguyên tố X thuộc chu kì 3, nhóm IIIA. Nguyên tử của nguyên tố X có cấu hình electron là
X thuộc chu kì 3, nhóm IIIA nên có 3 lớp electron, lớp ngoài cùng có 3 electron.
Cấu hình electron của X là: 1s22s22p63s23p1.
Dùng bình thủy tinh có thể chứa được tất cả các dung dịch acid trong dãy nào dưới đây:
Do HF ăn mòn thủy tinh nên không đựng được trong bình thủy tinh.
Phương án đúng là: HCl, H2SO4, HNO3.
Cho phương trình nhiệt hóa học của phản ứng trung hòa sau:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) ∆H = –57,3 kJ
Phát biểu nào sau đây không đúng?
Theo bài ra ta có: ∆H = –57,3 kJ < 0
⇒ Phản ứng tỏa nhiệt.
Từ phương trình ta thấy 1 mol HCl tác dụng với 1 mol NaOH.
Nhưng vậy cho 1 mol HCl tác dụng với 1 mol NaOH tỏa nhiệt lượng là 57,3 kJ.
Hydrogen halide nào sau đây có nhiệt độ sôi cao bất thường so với các hydrogen halide còn lại?
HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên hết hydrogen.
H-F…H-F…H-F
Dùng không khí nén nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào ảnh hưởng đến tốc độ phản ứng?
Không khí trước khi thổi vào lò luyện gang được nén lại để làm tăng áp suất, và được thổi qua bề mặt nóng của than cốc
Vậy các yếu tố ảnh hưởng đến tốc độ phản ứng là nhiệt độ, áp suất.
Mức độ ảnh hưởng của tương tác van der Waals so với liên kết hydrogen
Mức độ ảnh hưởng của tương tác van der Waals yếu hơn so với liên kết hydrogen
Sử dụng làm chất tẩy trắng và khử trùng nước là ứng dụng của
Chlorine là chất oxi hóa mạnh, được sử dụng làm chất tẩy trắng và khử trùng nước.
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị hai không đổi trong hợp chất) trong hỗn hợp khí X gồm Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (đktc). Kim loại M
mrắn sau − mM = mX ⇒ 71.nCl2 + 32.nO2 = 23 − 7,2 = 15,8 g (1)
⇒ nkhí = nCl2 +nO2 = 0,25 mol (2)
Từ (1) và (2) ⇒ nCl2 = 0,2; nO2 = 0,05 mol
Gọi hóa trị của M là x
Bảo toàn electron:
0,6/x 0,6
0,2 0,4
0,05 0,2
Cho 2,24 gam hỗn hợp gồm: CaCO3 và Mg vào một lượng dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn thấy thoát ra 0,7437 lít hỗn hợp khí ở đkc. Xác định phần trăm khối lượng của CaCO3 trong hỗn hợp ban đầu.
nkhí = 0,03 mol
Gọi số mol CaCO3 là x (mol); số mol Mg là y (mol).
Phương trình hoá học:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O (1)
x → x mol
Mg + 2HCl → MgCl2 + H2 (2)
y → y mol
Theo bài ra, ta có hệ phương trình:
