Lớp L có số electron tối đa là
Lớp thứ n (n ≤ 4) chứa tối đa 2n2 electron.
Lớp L (n = 2) có số electron tối đa là: 2n2 = 2.22 = 8.
Lớp L có số electron tối đa là
Lớp thứ n (n ≤ 4) chứa tối đa 2n2 electron.
Lớp L (n = 2) có số electron tối đa là: 2n2 = 2.22 = 8.
Định nghĩa về đồng vị nào sau đây đúng?
Đồng vị là tập hợp các nguyên tử có cùng số proton, khác nhau số neutron.
Nhận định nào không đúng khi nói về neutron?
Phát biểu "Có khối lượng bằng khối lượng proton." Khối lượng neutron xấp xỉ bằng khối lượng proton.
Chọn phát biểu đúng?
Khối lượng riêng của hạt nhân lớn hơn khối lượng riêng của nguyên tử.
Mỗi orbital nguyên tử được biểu diễn bằng
Mỗi orbital nguyên tử được biểu diễn bằng một ô vuông.
Trong tự nhiên, oxygen có 3 đồng vị là 16O,17O, 18O. Có bao nhiêu loại phân tử O2?
Có 6 loại phân tử O2 là: 16O–16O; 16O–17O; 16O–18O; 17O–17O; 17O–18O; 18O–18O;
Phát biểu nào sau đây không đúng?
Phát biểu “Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton và bằng số neutron” là sai.
Sửa lại đúng là: Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton và bằng số electron.
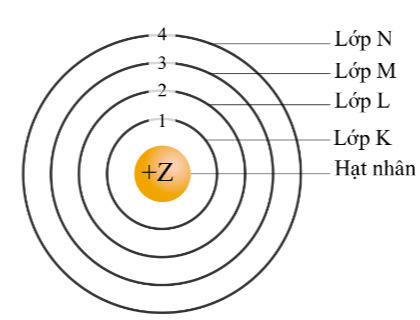
Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của các lớp thứ nhất, thứ hai, thứ ba, thứ tư lần lượt là
Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của các lớp như sau:
Lớp thứ nhất được gọi là lớp K
Lớp thứ hai được gọi là lớp L
Lớp thứ ba được gọi là lớp M
Lớp thứ tư được gọi là lớp N.
Nếu phóng đại một nguyên tử gold (Au) lên 1 tỉ (109) lần thì kích thước của nó tương đương một quả bóng rổ (có đường kính 30 cm) và kích thước của hạt nhân tương đương một hạt cát (có đường kính 0,003 cm). Cho biết kích thước nguyên tử Au lớn hơn so với hạt nhân bao nhiêu lần?
Khi phóng đại 1 nguyên tử vàng lên 1 tỉ lần thì:
- Đường kính nguyên tử: 30 cm
- Đường kính hạt nhân: 0,003 cm
Vậy nguyên tử vàng lớn hơn so với hạt nhân số lần:
Tỉ lệ phần trăm số nguyên tử các đồng vị tự nhiên của chlorine (Cl) được xác định theo phổ khối lượng sau:
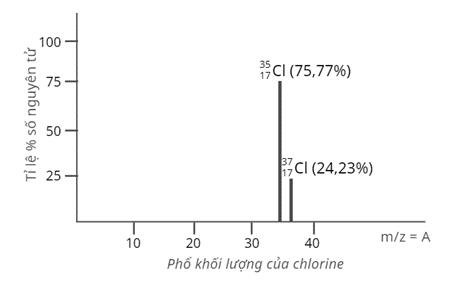
Nguyên tử khối trung bình của Cl là
Nguyên tử khối trung bình của Cl là:
Tổng số hạt p, n, e trong phân tử MX3 là 196, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 60. Khối lượng nguyên tử của X lớn hơn của M là 8. Tổng số hạt p, n, e trong X- nhiều hơn trong M3+ là 16. M và X lần lượt là?
Tổng số các hạt trong phân tử MX3 là 196
2ZM + NX +3.(2ZX + NX) = 196
⇔ (2ZM + 6ZX) + (NX + 3NX) = 196 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 60 hạt
→ (2ZM + 3.2ZX) − (NM + 3.NX) = 60 (2)
Giải hệ phương trình (1), (2)
→2ZM+3.2ZX=128 ⇔ ZM + 3ZX = 64 (3),
NM + 3.NX = 68
Khối lượng nguyên tử của X lớn hơn của M là 8
→ (NX + ZX) − (NM + ZM) = 8 (4)
Tổng số hạt trong X− nhiều hơn trong M3+ là 16
→(2ZX + NX + 1) − (2ZM + NM - 3) = 16
⇔ 2ZX + NX − (2ZM + NM) = 12 (5)
Lấy (5) - (4): ZX − ZM = 4 (6)
Giải hệ (3), (6) ta đc: ZM = 13; ZX = 17
Vậy M là Al và X là Cl
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số neutron
Điện tích của electron là
Điện tích của electron là: qe = –1,602.10–19 C.
Nguyên tử M có cấu hình electron 1s22s22p4. Phân bố electron trên các orbital là:
Quy tắc khi điền electron vào orbital:
Điền electron vào từng orbital theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng một mũi tên. Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất, electron được điền vào các ô orbital theo thứ tự từ trái sang phải. Trong một ô orbital, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống.
⇒ Phân bố electron trên các orbital của nguyên tử M là: ![]()
Một nguyên tử phosphorus có 15 proton, 15 electron và 16 neutron. Điện tích hạt nhân nguyên tử này là
Điện tích hạt nhân = + Z
Điện tích hạt nhân nguyên tử phosphorus là +15.
Phát biểu nào sau đây là sai?
Trong nguyên tử, electron chuyển động rất nhanh và không theo quỹ đạo xác định.
Ở mỗi phát biểu sau chọn đúng hoặc sai:
(a) Điện tích của proton và electron có cùng độ lớn nhưng ngược dấu. Đúng || Sai
(b) Có những nguyên tử không chứa neutron nào. Đúng || Sai
(c) Một số nguyên tử không có bất kì proton nào. Sai || Đúng
(c) Khôi lượng của proton và neutron xấp xỉ bằng nhau và lớn hơn nhiều khối lượng electron. Đúng || Sai
Ở mỗi phát biểu sau chọn đúng hoặc sai:
(a) Điện tích của proton và electron có cùng độ lớn nhưng ngược dấu. Đúng || Sai
(b) Có những nguyên tử không chứa neutron nào. Đúng || Sai
(c) Một số nguyên tử không có bất kì proton nào. Sai || Đúng
(c) Khôi lượng của proton và neutron xấp xỉ bằng nhau và lớn hơn nhiều khối lượng electron. Đúng || Sai
(a) đúng.
(b) đúng.
(c) sai vì nguyên tử bắt buộc phải có proton.
(d) đúng.
Nguyên tử X có số hiệu nguyên tử Z = 15. Lớp electron nào trong nguyên tử X có mức năng lượng cao nhất?
Cấu hình electron của nguyên tử X (Z = 15): 1s22s22p63s23p3.
Nguyên tử X có 3 lớp electron Lớp electron thứ ba (n = 3, lớp M) trong nguyên tử X có mức năng lượng cao nhất.
Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng, và điện tích của chúng?
Sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng là:
Neutron, m ≈ 1 amu, q = 0
Proton, m ≈ 1 amu, q = +1
Electron, m ≈ 0,00055 amu, q = -1.
Cặp nguyên tử nào có cùng số neutron?
và
có cùng số neutron là 1.
