Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng
Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion.
Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng
Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion.
Đâu không phải đặc điểm của phản ứng oxi hóa – khử?
Chất khử là chất nhường electron.
Hãy cho biết dãy nào sau đây số oxi hóa của nguyên tố hydrogen luôn là +1?
Dãy có số oxi hóa của nguyên tố hydrogen luôn là +1 là HF, H2O2, C2H2, NH3
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
2Ca0 + O02 2Ca+2O-2
Là phản ứng oxi hóa khử vì có xảy ra quá trình nhường, nhận electron (có sự thay đổi số oxi hóa của các chất trong phản ứng).
Cho 0,05 mol Mg và 0,1 mol Ag tác dụng hoàn toàn với HNO3 tạo ra Mg(NO3)2, AgNO3, H2O và V lít khí NO2 (đktc). Giá trị của V là bao nhiêu?
Áp dụng định luật bảo toàn e ta có
Ta có ∑ne cho = ∑ne nhận
2nMg + nAg = nNO2
nNO2 = (0,05.2 + 0,1) = 0,2 mol
VNO2 = 0,2.22,4 = 4,48 lít
Trong phản ứng nào dưới đây HCl thể hiện tính oxi hoá?
Phương trình:
HCl + AgNO3 → AgCl + HNO3
HCl không thể hiện tính oxi hóa
2HCl + Mg → MgCl2 + H2.
H+1 + 2e → H0 (HCl thể hiện tính oxi hóa)
Ta có 2 phương trình:
8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O (1)
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O (2)
2Cl-1 → Cl20 + 2e (HCl (1) và (2) đều thể hiện tính khử)
Cho phương rình phản ứng hóa học sau:
(1) 4HClO3 + 3H2S → 4HCl + 3H2SO4.
(2) Fe + 6HNO3 → Fe(NO3)3 + 3NO2 ↑ + 3H2O.
(3) 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Trong các phản ứng trên các chất khử là:
Chất khử (chất bị oxi hoá) là chất nhường electron.
Chất oxi hoá (chất bị khử) là chất nhận electron.
Xét các phương trình phản ứng ta có:
(1)
Chất khử: H2S
Chất oxi hóa: HClO3
Chất khử: Fe
Chất oxi hóa: HNO3
Chất khử: HCl
Chất oxi hóa: KMnO4
Vậy chất đóng vai trò là chất khử: H2S, Fe, HCl
Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu.
Trong phản ứng trên xảy ra
Xảy ra sự oxi hóa Fe
Xảy ra sự khử Cu2+
Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận?
Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận electron.
Gỉ sét là quá trình oxi hoá kim loại, mỗi năm phá huỷ khoảng 25 % sắt thép. Gỉ sét được hình thành do kim loại sắt (Fe) trong gang hay thép kết hợp với oxygen khi có mặt nước hoặc không khí ẩm. Trên bề mặt gang hay thép bị gỉ hình thành những lớp xốp và giòn dễ vỡ, thường có màu nâu, nâu đỏ hoặc đỏ. Lớp gỉ này không có tác dụng bảo vệ sắt ở phía trong. Sau thời gian dài, bất kì khối sắt nào cũng sẽ bị gỉ hoàn toàn và phân huỷ. Thành phần chính của sắt gỉ gồm Fe(OH)2, Fe2O3.nH2O.
Một số phản ứng xảy ra trong quá trình gỉ sắt:
(1) Fe + O2 + H2O → Fe(OH) 2
(2) Fe + O2 + H2O + CO2 → Fe(HCO3)2
(3) Fe(HCO3)2 → Fe(OH)2 + CO2
(4) Fe (OH)2 + O2 + H2O → Fe2O3.nH2O
Có bao nhiêu phản ứng ở trên là phản ứng oxi hoá – khử?
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
⇒ Phản ứng (1), (2) và (4) là phản ứng oxi hoá – khử.
2Fe + O2 + 2H2O → 2Fe(OH)2 (1)
Chất oxi hoá: O2 (số oxi hóa từ 0 xuống -2); Chất khử: Fe (số oxi hóa từ 0 lên +2)
2Fe + O2 + 2H2O + 4CO2 → 2Fe(HCO3)2 (2)
Chất oxi hoá: O2 (số oxi hóa từ 0 xuống -2); Chất khử: Fe (số oxi hóa từ 0 lên +2)
2Fe(OH)2 + O2 + (2n – 4)H2O → 2Fe2O3.nH2O (4)
Chất oxi hoá: O2 (số oxi hóa từ 0 xuống -2); Chất khử: Fe(OH)2 (số số oxi hóa từ +2 lên +3).
Trong các phản ứng: Fe + CuSO4 → FeSO4 + Cu. Chất bị oxi hóa là
Quá trình nhường electron là sự oxi hóa, quá trình nhận electron là
Fe + CuSO4 → FeSO4 + Cu
Fe → Fe2+ +2e (sự oxi hóa)
Cu2++ 2e → Cu (sự khử)
Để m gam bột Fe ngoài không khí một thời gian thu được 23,6 gam hỗn hợp các chất rắn FeO, Fe3O4, Fe2O3, Fe. Hòa tan hoàn toàn hỗn hợp đó bằng dung dịch HNO3 loãng thu được muối sắt (III) và 4,48 lít khí NO duy nhất (đktc). Giá trị của m là bao nhiêu?
nNO = 0,2 mol
Áp dụng BTKL: mO2 = mhh - mFe = 23,6 - m ⇒
Quá trình nhường e Fe0 → Fe+3 + 3e
| Quá trình nhận e O2 + 4e → 2O-2 N+5 + 3e → N+2 |
Áp dụng định luật bảo toàn electron, ta có:
3nFe = 4nO2 + 3.nNO
= 4.
+ 3. 0,2
⇒ m = 19,88 gam.
Cho sơ đồ phản ứng:
aKMnO4 + bKI + cH2SO4 → K2SO4 + MnSO4 + I2 + H2O
Hệ số cân bằng a, b, c của các chất phản ứng lần lượt là:
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố trước và sau phản ứng:
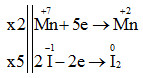
Cân bằng:
2KMnO4 + 10KI + 8H2SO4 → 6K2SO4 + 2MnSO4 + 5I2 + 8H2O
Vậy a = 2; b = 10; c = 8
Cho 3,51 g kim loại M (hóa trị n) tác dụng với dung dịch H2SO4 (đặc nóng, dư) thu được muối sulfate của M, 4,83405 lít SO2 (đkc), và nước. Xác định kim loại M.
nSO2 = 4,83405 : 24,79 = 0,195 mol
Sơ đồ phản ứng
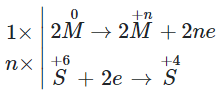
Phương trình phản ứng: 2M + 2nH2SO4 → M2(SO4)n + nSO2 + 2nH2O
Theo phương trình phản ứng ta có:
Lập bảng biện luận ta có:
| n | 1 | 2 | 3 |
| M | 9 (Loại) | 18 (Loại) | 27 (Al) |
Vậy kim loại M là Al (Aluminium)
Trong phản ứng: 2FeCl3 + H2S → 2FeCl2 + S + 2HCl.
Vai trò của FeCl3 là
2Fe+3Cl3 + H2S-2 → 2Fe+2Cl2 + S0 + 2HCl
Fe trong FeCl3 có số oxi hóa giảm sau phản ứng → FeCl3 đóng vai trò là chất oxi hóa
Số oxi hóa của chromium (Cr) trong Na2CrO4 là:
Trong Na2CrO4, số oxi hóa của O là -2; số oxi hóa của Na là +1.Gọi số oxi hoá của chromium là x. Ta có:
2 × (+1) + x + 4 × (-2) = 0 ⇒ x = +6.
Dãy nào sau đây sắp xếp theo chiều tăng dần số oxy hóa nguyên tố Nitrogen?
Số oxi hóa của nguyên tố N trong các chất:
Trong hợp chất H2SO4, số oxi hoá của sulfur (lưu huỳnh) là
Trong H2SO4:
2.(+1) + x + 4.(-2) x = +6
Chất khử là chất
Chất khử là chất cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
Nguyên tử sulfur chỉ thể hiện tính khử (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây?
Trong hợp chất H2S, S có số oxi hóa –2, là số oxi hóa thấp nhất của lưu huỳnh nên chỉ thể hiện tính khử.
