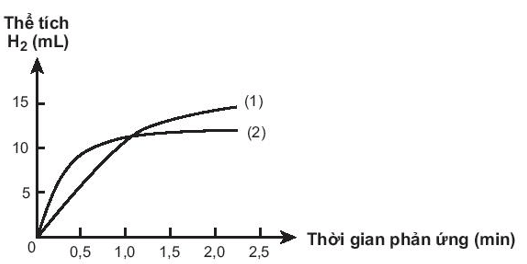
Có hai miếng iron có kích thước giống hệt nhau, một miếng là khối iron đặc (A), một miếng có nhiều lỗ nhỏ li ti bên trong và trên bề mặt (B). Thả hai miếng iron vào hai cốc đựng dung dịch HCl cùng thể tích và nồng độ, theo dõi thể tích khi hydrogen thoát ra theo thời gian. Vẽ đồ thị thể tích khi theo thời gian, thu được hai đồ thị sau:

Cho các phát biểu sau, các phát biểu đúng là:
(1) Miếng iron có nhiều lỗ có diện tích bề mặt lớn hơn nên lúc đầu có tốc độ phản ứng với HCl cao hơn.
(2) Đồ thị (2) mô tả tốc độ thoát khí từ miếng iron (A).
(3) Đồ thị (1) mô tả tốc độ thoát khí từ miếng iron (B).
(4) Khi 2 miếng iron chưa phản ứng hết, thể tích khí H2 thoát ra của miếng iron (B) nhiều hơn miếng iron (A).