Một loại nguyên tử potassium có 19 proton, 19 electron và 20 neutron. Số khối của nguyên tử này là
Số khối A = số proton + số neutron = 19 + 20 = 39
Vậy số khối của nguyên tử này là 39
Một loại nguyên tử potassium có 19 proton, 19 electron và 20 neutron. Số khối của nguyên tử này là
Số khối A = số proton + số neutron = 19 + 20 = 39
Vậy số khối của nguyên tử này là 39
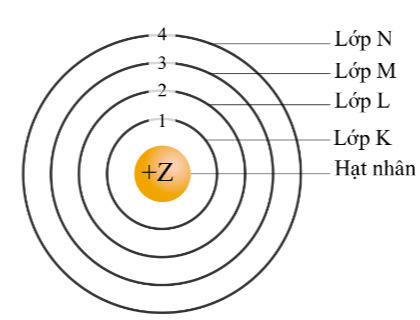
Khi nói về mô hình Rutherford – Bohr phát biểu nào sau đây không đúng?
Phát biểu Electron trên lớp K có năng lượng cao hơn trên lớp L sai vì: Electron trên lớp K có năng lượng thấp hơn trên lớp L.
Trong công nghiệp hàn kim loại, Argon được sử dụng như là môi trường khí trơ, phục vụ hàn kim loại khí trơ và hàn vonfram khí trơ. Nguyên tử Argon có số khối bằng 40 và 22. Dựa vào cấu hình electron nguyên tử dự đoán Argon là:
Ta có
Số khối = Z + N => Z = A - N = 40 - 22 = 18
Cấu hình electron của Argon là 1s22s22p63s23p6 nhận thấy Argon có 8 electron ở lớp ngoài cùng.
Từ đó có thể dự đoán Argon là nguyên tố khí hiếm
Thông tin về 4 đồng vị của nguyên tố Y được ghi nhận theo bảng sau:
| Đồng vị | A1Y1 | A2Y2 | A3Y3 | A4Y4 |
| Tỉ lệ phần trăm số nguyên tử | 4,34 | 83,79 | 9,50 | 2,37 |
| Thông tin về số hạt neutron trong hạt nhân | Ít hơn đồng vị A2Y2 là 2 neutron | - | Nhiều hơn đồng vị A2Y2 là 1 neutron | Nhiều hơn đồng vị A2Y2 là 2 neutron |
Biết đồng vị A2Y2 có tổng số hạt cơ bản là 76, trong đó tỉ lệ giữa số hạt mang điện trong hạt nhân và số hạt không mang điện là 6 : 7. Nguyên tử khối trung bình của Y là
Xét đồng vị A2Y2, ta có hệ:
A2 = 24 + 28 = 52
A1Y1 ít hơn đồng vị A2Y2 là 2 neutron A1 = 24 + 26 = 50
A3Y3 nhiều hơn đồng vị A2Y2 là 1 neutron A3 = 24 + 29 = 53
A4Y4 nhiều hơn đồng vị A2Y2 là 2 neutron A4 = 24 + 30 = 54
Nguyên tử khối trung bình của Y là:
Trong nguyên tử hạt mang điện là hạt:
Trong nguyên tử: hạt electron mang điện tích âm, hạt proton mang điện tích dương, hạt neutron không mang điện.
=> Trong nguyên tử, hạt mang điện là proton và electron.
Ở trạng thái cơ bản, trong nguyên tử, electron chiếm các mức năng lượng
Ở trạng thái cơ bản, trong nguyên tử, electron chiếm các mức năng lượng lần lượt từ thấp đến cao.
Ion M2+ có số electron là 18, điện tích hạt nhân của ion M2+ là
M →M2+ + 2e
eM = 18 + 2=20;
Mà pM2+ = pM = eM→ pM2+ = 20
Thành phần nào không bị lệch hướng trong trường điện?
Nguyên tử hydrogen trung hòa về điện nên không bị lệch hướng trong trường điện.
Nguyên tố nào sau đây có kí hiệu là H?
Nguyên tố hydrogen có kí hiệu là H.
Aluminium là kim loại phổ biến nhất trên vỏ Trái Đất, được sử dụng trong các ngành xây dựng, ngành điện, hoặc sản xuất đồ gia dụng. Hạt nhân nguyên tử aluminium có điện tích bằng +13 và số khối là 27. Số proton, neutron và electron có trong nguyên tử aluminium lần lượt là
Hạt nhân nguyên tử có điện tích là +13.
Số đơn vị điện tích hạt nhân = số proton = số electron = 13
- Số khối = số proton + số neutron
27 = 13 + số neutron
Số neutron = 27 - 13 = 14
Số proton, neutron và electron có trong nguyên tử aluminium lần lượt là 13, 14, 13.
Số electron tối đa ở lớp thứ n (n ≤ 4) là
Số electron tối đa ở lớp thứ n (n ≤ 4) là 2n2
Ví dụ: Số electron tối đa ở lớp thứ tư (n = 4) là 2.42 = 32
Những nguyên tử ![]() ,
, ![]() ,
, ![]() có cùng:
có cùng:
có số nơtron là 40 – 20 = 20
có số nơtron là 39 – 19 = 20
có số nơtron là 41 – 21 = 20
Lithium có 2 đồng vị là 7Li và 6Li. Nguyên tử khối trung bình của Li là 6,93. Phần trăm số nguyên tử của đồng vị 7Li là:
Gọi phần trăm số nguyên tử của đồng vị 7Li là x%
⇒ Phần trăm số nguyên tử của đồng vị 6Li là (100 − x)%
Ta có:
⇒ x = 93
Phần trăm số nguyên tử của đồng vị 7Li là 93%.
Phát biểu nào sau đây không đúng?
Các electron trong cùng một lớp có mức năng lượng gần bằng nhau.
Thành phần cấu tạo của nguyên tử gồm:
Hạt nhân: ở tâm của nguyên tử, chứa các proton||neutron||electron mang điện tích dương||âm||không mang điện và các neutron||proton||electron không mang điện||âm||dương
(trừ trường hợp 11H).
Vỏ nguyên tử: chứa các electron||neutron||protonmang điện tích âm||dương||không mang điện, chuyển động rất nhanh xung quanh hạt nhân.
Thành phần cấu tạo của nguyên tử gồm:
Hạt nhân: ở tâm của nguyên tử, chứa các proton||neutron||electron mang điện tích dương||âm||không mang điện và các neutron||proton||electron không mang điện||âm||dương
(trừ trường hợp 11H).
Vỏ nguyên tử: chứa các electron||neutron||protonmang điện tích âm||dương||không mang điện, chuyển động rất nhanh xung quanh hạt nhân.
Nguyên tố hóa học là những nguyên tử có cùng
Nguyên tố hoá học là tập hợp các nguyên tử cùng loại, có cùng số proton trong hạt nhân. Mỗi nguyên tố hoá học sẽ được xác định dựa theo số proton trong hạt nhân nguyên tử của nó.
Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
Lớp K là lớp gần hạt nhân nhất nên nó liên kết chặt chẽ với hạt nhân.
Khối lượng của fluorine (F) theo amu là 19,1608. Khối lượng fluorine theo đơn vị kg là
Ta có: 1 amu = 1,66.10–24 g = 1,66.10–27 kg
Khối lượng fluorine theo đơn vị kg là: mF = 19,1608.1,66.10–27 = 31,807.10–27 (kg)
Có các nhận định sau:
a) Nguyên tử nguyên tố có cấu hình e lớp ngoài cùng là 3s23p5 thì nguyên tố đó là kim loại
b) Hạt nhân nguyên tử gồm hạt proton và electron
c) Lớp K là lớp có mức năng lượng thấp nhất
d) Ion X có cấu hình e là 1s22s22p6. Vậy nguyên tố X là khí hiếm
e) Nguyên tử khối của nguyên tố X là 17. Tính gần đúng thì khối lượng nguyên tử nguyên tố đó nặng gấp 17 lần đơn vị khối lượng.
Số nhận định sai là:
Ý a) sai vì nguyên tử nguyên tố có cấu hình e lớp ngoài cùng là 3s23p5 thì nguyên tố đó là phi kim
Ý b) sai vì hạt nhân nguyên tử gồm hạt proton và neutron.
Ý d) sai vì ion X- có cấu hình e là 1s22s22p6
= Cấu hình electron X: 1s22s22p5 = Vậy nguyên tố X là phi kim.
Vậy số nhận định sau là 3.
Thông tin nào sau đây là không đúng?
Electron mang điện tích âm (-)
⇒ qe = -1,602.10-19 coulomb.
