Cho những nguyên tử của các nguyên tố sau:
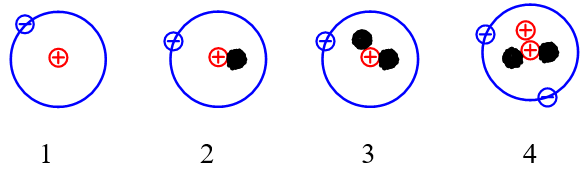
Những nguyên tử nào sau đây là đồng vị của nhau?
Đồng vị là những nguyên tử có cùng số proton nhưng khác nhau về số neutron dẫn đến số khối của chúng khác nhau.
Vậy các nguyên tử (1), (2), (3) là đồng vị của nhau do có số proton là 1.








