Khi tăng nồng độ chất tham gia, thì
Khi tăng nồng độ chất tham gia, thì tốc độ phản ứng tăng.
Khi tăng nồng độ chất tham gia, thì
Khi tăng nồng độ chất tham gia, thì tốc độ phản ứng tăng.
Chọn câu đúng trong các câu dưới đây?
Từ một miếng đá vôi và một lọ dung dịch HCl 1 M, thí nghiệm được tiến hành trong điều kiện nào sau đây sẽ thu được lượng CO2 lớn nhất trong một khoảng thời gian xác định?
Lượng CO2 sẽ thu được lớn nhất khi tiến hành trong điều kiện: Tán nhỏ miếng đá vôi, cho vào dung dịch HCl 1M, đun nóng.
Cho phương trình nhiệt hóa học sau:
H2 (g) + I2 (g) → 2HI(g) ∆H = +11,3 kJ.
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
∆H = +11,3 kJ > 0 ⇒ phản ứng thu nhiệt.
phản ứng thu nhiệt nên tổng nhiệt cần cung cấp để phá vỡ liên kết lớn hơn nhiệt giải phóng khi tạo sản phẩm.
Phân tử H2 và I2 có liên kết bền hơn HI, nghĩa là mức năng lượng thấp hơn.
Không nói về sự trao đổi năng lượng của phản ứng.
Phát biểu nào sau đây sai?
Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ của phản ứng rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn), để ủ rượu?
Men là chất xúc tác để làm tăng tốc độ phản ứng lên men tinh bột thành rượu.
Dùng không khí nén nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào ảnh hưởng đến tốc độ phản ứng?
Không khí trước khi thổi vào lò luyện gang được nén lại để làm tăng áp suất, và được thổi qua bề mặt nóng của than cốc
Vậy các yếu tố ảnh hưởng đến tốc độ phản ứng là nhiệt độ, áp suất.
Aluminium dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với aluminium dạng lá tốc độ phản ứng trên chịu ảnh hưởng của yếu tố nào sau đây
Ảnh hưởng bởi yếu tố bề mặt tiếp xúc. Aluminum dạng bột có bề mặt tiếp xúc lớn hơn dạng lá, phản ứng xảy ra nhanh hơn.
Ảnh hưởng của chất xúc tác đối với phản ứng hóa học là:
Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về chất lượng khi kết thúc.
Chất độc màu da cam dioxin gây tác hại vô cùng nghiêm trọng đối với môi trường và sức khỏe con người. Nó phân hủy vô cùng chậm trong đất. Nghiên cứu cho thấy phải mất tám năm để lượng dioxin trong đất giảm đi một nửa. Nếu một mảnh đất có chứa 0,352 mg dioxin thì sau bao lâu lượng dioxin còn lại là 2,2.10-5 g dioxin?
Từ 0,352 mg dioxin phân hủy còn lại là 2,2.10-5 g dioxin tức đã giảm:
Thời gian cần thiết để 0,352 mg dioxin phân hủy còn lại là 2,2.10-5 g dioxin là:
8.4 = 32 năm
Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất sản phẩm trong một đơn vị
Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất sản phẩm trong một đơn vị thời gian.
Cho phản ứng: 2SO2 + O2 ![]() 2SO3. Biết thể tích bình phản ứng không đổi. Tốc độ phản ứng tăng lên 16 lần khi:
2SO3. Biết thể tích bình phản ứng không đổi. Tốc độ phản ứng tăng lên 16 lần khi:
Gọi k là hằng số tốc độ phản ứng Công thức tính tốc độ phản ứng theo k:
- Khi tăng nồng độ của SO2 lên 2 lần thì tốc độ phản ứng tăng lên 22 = 4 lần.
- Khi tăng nồng độ của SO2 lên 4 lần thì tốc độ phản ứng tăng lên 42 = 16 lần.
- Khi tăng nồng độ của O2 lên 2 lần thì tốc độ phản ứng tăng lên 2 lần.
- Khi tăng đồng thời nồng độ SO2 và O2 lên 2 lần thì tốc độ phản ứng tăng lên 22.2 = 8 lần.
Đối với phản ứng có chất khí tham gia thì
Đối với phản ứng có chất khí tham gia, khi áp suất tăng, tốc độ phản ứng tăng.
Cho phan ứng của các chất ở thể khí: 2NO + O2 ![]() 2NO2
2NO2
Biểu thức nào sau đây không đúng?
Theo biểu thức tính tốc độ trung bình của phản ứng ta có:
Đồ thị dưới đây biểu diễn sự phụ thuộc của tốc độ phản ứng vào nhiệt độ.
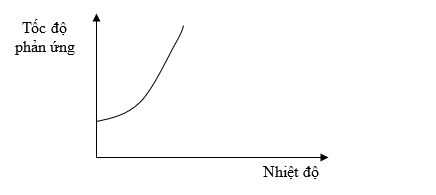
Từ đồ thị trên, ta thấy tốc độ phản ứng
Theo đồ thị ta thấy khi nhiệt độ tăng, tốc độ phản ứng tăng.
Những ngày Tết, lượng thực phẩm nhiều được bảo quản trong tủ lạnh giúp cho thực phẩm được tươi lâu hơn, tốc độ phản ứng trên chịu ảnh hưởng của yếu tố nào?
Ảnh hưởng bởi yếu tố nhiệt độ. Quá trình bảo quản thực phẩm là hạn chế vi khuẩn hoạt động phá huỷ thức ăn, khi bảo quản trong tủ lạnh, nhiệt độ thấp sẽ giảm khả năng hoạt động của vi khuẩn, làm chậm quá trình phá huỷ thức ăn.
Cho phản ứng hóa học: H2(g) + I2(g) → HI(g). Tốc độ trung bình của phản ứng tính theo nồng độ chất sản phẩm là:
Chất sản phẩm là HI. Tốc độ phản ứng tính theo nồng độ chất sản phẩm là:
Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3,5. Ở 20°C, tốc độ của phản ứng này bằng 0,2 Ms-1. Tốc độ của phản ứng ở 45°C là
Cho phản ứng: X(g) + Y(g) → Z(g) + T(g)
Nếu tăng nồng độ chất Y lên 4 lần và nồng độ chất X giảm đi 2 lần thì tốc độ phản ứng tăng hay giảm bao nhiêu lần?
2X(g) + Y(g) → Z(g) + T(g)
Vban đầu = k.[X].[Y]2=kab2 (với a, b là nồng độ chất X, Y).
Vsau = k.
Vậy tốc độ tăng lên 8 lần
Tốc độ phản ứng tính theo định luật tác dụng khối lượng là
Tốc độ phản ứng tính theo định luật tác dụng khối lượng là tốc độ tức thời của phản ứng tại một thời điểm.
