Để chứng minh SO2 là một acid oxide, người ta cho SO2 phản ứng với chất nào sau đây?
Để chứng minh SO2 là một acid oxide, người ta cho SO2 phản ứng với dung dịch kiềm
SO2 + 2NaOH → Na2SO3 + H2O
Để chứng minh SO2 là một acid oxide, người ta cho SO2 phản ứng với chất nào sau đây?
Để chứng minh SO2 là một acid oxide, người ta cho SO2 phản ứng với dung dịch kiềm
SO2 + 2NaOH → Na2SO3 + H2O
Hợp chất nào dưới đây của nitrogen không được tạo ra khi cho HNO3 tác dụng với kim loại:
Hợp chất N2O5 của nitrogen không được tạo ra khi cho HNO3 tác dụng với kim loại:
Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương úng là 1:3. Nung nóng X trong bình kín (450 °C, xúc tác Fe) một thời gian, thu được hỗn hợp khí có số mol giảm 5% so với ban đầu. Tính hiệu suất của phản ứng tổng hợp NH3.
- Giả sử số mol ban đầu của N2 là 1 mol, của H2 là 3 mol.
⇒ Tổng số mol khí ban đầu là 4 mol.
N2(g) + 3H2(g) 2NH3(g)
Ban đầu: 1 3 (mol)
Phản ứng: x 3x 2x (mol)
Cân bằng: 1 − x 3 − 3x 2x (mol)
⇒ Tổng số mol khí sau khi phản ứng là: 1 − x + 3 − 3x + 2x = 4 − 2x
- Số mol khí giảm so với ban đầu là 2x mol.
Hỗn hợp khí có số mol giảm đi 5% so với ban đầu nên: 2x = 5% × 4 ⇒ x = 0,1.
⇒ Hiệu suất của phản ứng là:
Trong không khí, chất nào sau đây chiếm phần trăm thể tích lớn nhất?
Trong không khí, nitrogen chiếm phần trăm thể tích lớn nhất (khoảng 78%).
Trong nhiệt kế chứa Hg rất độc. Khi nhiệt kế bị vỡ người ta thường dùng chất nào sau đây để thu hồi thủy ngân là tốt nhất?
Khi nhiệt kế bị vỡ người ta thường dùng sulfur để thu hồi thủy ngân, vì sulfur tác dụng với thủy ngân ở nhiệt độ thường tạo ra HgS:
S + Hg → HgS
Nitric acid là một acid có tính
Nitric acid là một acid có tính acid mạnh nên có thể oxi hóa được hầu hết các kim loại trừ vàng (Au), platinum (Pt)...
Xét phản ứng trong quá trình tạo ra NOx nhiệt:
N2(g) + O2(g) → 2NO(g) ![]() = 180,6 kJ
= 180,6 kJ
Nhiệt tạo thành chuẩn của NO(g) là
Phản ứng trên tổng hợp khí NO(g) từ dạng đơn chất bền nhất của nguyên tố N và O, nhưng sau phản ứng lại tổng hợp được 2 mol NO(g). Vậy nên, nhiệt tạo thành chuẩn của NO(g) phải bằng 1 nửa của nhiệt phản ứng: N2(g) + O2(g) → 2NO(g).
Dãy chất nào sau đây phản ứng được với dung dịch Sulfuric acid đặc nguội?
Dung dịch Sulfuric acid đặc nguội không phản ứng được với Au, Fe, Al
Do đó đáp án có chất Zn, NaOH phản ứng được với Dung dịch Sulfuric acid đặc nguội.
Phương trình minh họa
2H2SO4 + Zn → ZnSO4 + 2H2O + SO2.
2NaOH + H2SO4 → Na2SO4 + 2H2O
Trong dung dịch NH3 là một base yếu vì:
Khi tan trong H2O, chỉ một phần nhỏ các phân tử NH3 kết hợp với ion H+ của H2O tạo ra các ion NH4+ và OH-.
Nung hỗn hợp M gồm a mol Mg và 0,25 mol Cu(NO3)2, sau một thời gian, thu được chất rắn X và 0,45 mol hỗn hợp khí Y gồm NO2 và O2. Cho X phản ứng vừa đủ với dung dịch chứa 1,3 mol HCl, thu được dung dịch chỉ chứa m gam hỗn hợp muối chloride và 0,05 mol hỗn hợp khí Z (gồm N2 và H2 có tỉ khối so với H2 là 11,4). Giá trị của m gần nhất với giá trị nào sau đây?
Ta có MZ = 11,4.2 = 22,8
Đặt N2 = x mol; nH2 = y mol
Ta có:
nkhí Z = nN2 + nH2 = x + y = 0,05 mol (1)
mZ = mN2 + mH2= 28x + 2y = 0,05.22,8 = 1,14 gam (2)
Từ (1) và (2) giải hệ phương trình
⇒ x = 0,04 mol; y = 0,01 mol
Vì có H2 bay lên nên trong dung dịch không còn NO3-
Áp dụng bảo toàn nguyên tố O ta có:
nO(M) = 6.nCu(NO3)2 - 2.nKhí Y = 6.0,25 - 2.0,45 = 0,6 mol = nH2O
Bảo toàn nguyên tố H:
nHCl = 4.nNH4Cl + 2.nH2 + 2.nH2O
⇒ nNH4Cl = (1,3 - 2.0,01 - 2.0,6) : 4 = 0,02 mol
Trong dung dịch chứa NH4+: 0,02 mol; Cu2+: 0,25 mol; Cl-; 1,3 mol và Mg2+: a mol
Áp dụng bảo oàn điện tích ta có:
0,02 + 2.0,25 = 1,3 + 2a ⇒ a = 0,39 mol
mmuối = mNH4+ + mCu2+ + mCl- + mMg2+
⇔ 0,02.18 + 0,25.64 + 1,3.35,5 + 0,39.24 = 71,78 gam.
Vậy m gần với giá trị 72 nhất
Nung 8,4 gam bột Iron và 19,5 gam Zinc với một lượng dư bột sulfur, sau phản ứng thu được rắn X. Hòa tan hoàn toàn X trong dung dịch Hydrochloric acid thu được khí Y. Dẫn khí Y vào V lít dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được m gam kết tủa. Giá trị của m là.
Phương trình phản ứng
Fe + S FeS
Zn + S ZnS
Ta có:
nFe = nFeS = 8,4 : 56 = 0,15 mol;
nZn = nZnS = 19,5 : 65 = 0,3 mol
Cho sản phẩm tác dụng hoàn toàn với HCl dư
FeS + 2HCl → FeCl2 + H2S
ZnS + 2HCl→ ZnCl2 + H2S
→ nH2S = nFeS + nZnS = 0,15 + 0,3 = 0,45 mol
Dẫn khí H2S dung dịch CuSO4 dư
H2S + CuSO4 → CuS↓ + H2SO4
Theo phản ứng:
nH2S = nCuS = 0,45 mol
mCuS = 0,45 . 96 = 43,2 gam
Phát biểu nào sau đây về nguyên tố nitrogen (7N) là không đúng?
Nguyên tử nguyên tố nitrogen có 5 electron hoá trị.
Ý nào sau đây là sai khi nói về nitric acid?
Nitric acid là một acid mạnh, có khả năng oxy hóa mạnh, ăn mòn kim loại ngoại trừ Au, Pt, ...
Chọn phương trình phản ứng đúng của thí nghiệm sau:
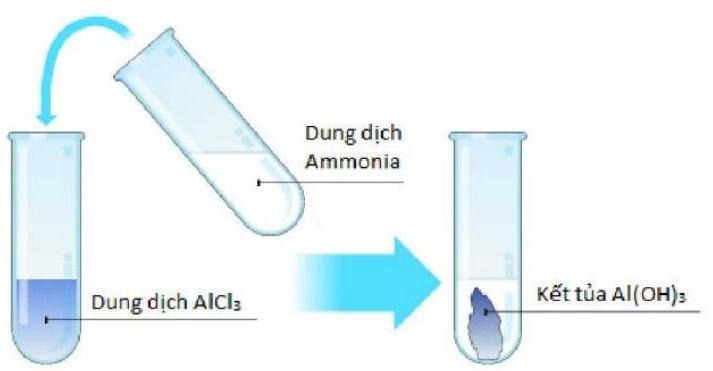
Phương trình phản ứng đúng của thí nghiệm là
AlCl3(aq) + 3NH3(aq) + 3H2O(l) → Al(OH)3(s) + 3NH4Cl(aq).
Để điều chế 2 lít ammonia từ nitrogen và hydrogen với hiệu suất 50% thì thể tích nitrogen cần dùng ở cùng điều kiện là
N2 + 3H2 2NH3
Theo phương trình phản ứng:
VH2 = .VNH3 = 6 lít
Do hiệu suất 50% nên:
VH2 thực tế = VH2/50% = 6/50% = 12 lít
Cho 6 gam hỗn hợp hai kim loại Fe, Cu tác dụng vừa đủ với dung dịch HNO363%. Sau phản ứng thu được dung dịch A và 5,6 lít khí NO2 duy nhất (đktc). Nồng độ % các chất có trong dung dịch A là:
Áp dụng định luật bảo toàn nguyên tố Nitrogen
=> nHNO3 = nNO3 + nNO2
Do nNO3 = ne trao đổi = nNO2
=> nHNO3 = 0,5 mol
mHNO3 = 0,5.63 = 31,5 gam
=> mdd HNO3 = 31.5: C% = 31,5: 63 . 100 = 50 (gam)
Áp dụng định luật bảo toàn khối lượng ta có:
m dung dịch muối = mhỗn hợp kim loại + mdd HNO3 – mNO2
= 6 + 50 – 0,25 .46 = 44,5 (gam)
Gọi số mol của Fe, Cu lần lượt là x, y mol
Ta có hệ phương trình như sau:
56x + 64y = 6
3x + 2y = 0,25
=> x = 0,05; y = 0,05
mFe(NO3)3 = 0,05.(56 + 62.3) = 12,1 (gam)
mCu(NO3)2 = 0,05.(64 + 62.2) = 9,4 (gam)
% mFe(NO3)3= 12,1 : 44,5. 100% = 27,19%
% mCu(NO3)2 = 9,4 : 44,5. 100% = 21,12%.
Các số oxi hóa thường gặp của sulfur là
Các số oxi hóa thường gặp của sulfur: -2, 0, +4, +6.
Tiến hành đun nóng NH4Cl trong ống nghiệm trên ngọn lửa đèn cồn, thấy hiện tượng khói trắng trong ống nghiệm. Khói trắng trong ống nghiệm là chất nào sau đây?
Đun nóng NH4Cl thấy có hiện tượng khói trắng trong ống nghiệm do NH4Cl bị phân huỷ tạo ra NH3(g) và HCl(g).
Phương trình hoá học minh hoạ:
NH4Cl NH3 + HCl
Dung dịch loãng acid nào sau đây hòa tan được lá bạc, tạo thành muối tương ứng:
Dung dịch HNO3 hòa tan đươc lá bạc
Khi cho dung dịch Ba(OH)2 vào dung dịch (NH4)2SO4 và đun nóng có hiện tượng
Phương trình hóa học:
Ba(OH)2 + (NH4)2SO4 BaSO4↓(trắng) + 2NH3↑(mùi khai) + 2H2O
