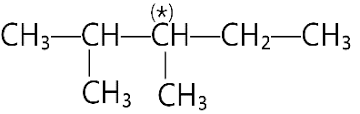
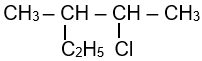Dãy nào sau đây chỉ gồm các chất thuộc dãy đồng đẳng của methane?
Đề kiểm tra 15 phút Hóa 11 Chương 4
- Thời gian làm: 25 phút
- Số câu hỏi: 20 câu
- Số điểm tối đa: 20 điểm
- Tài khoản: Đăng nhập
- 1 Ôn tập kiến thức đã nêu trong phần Mô tả thêm
- 2 Tìm không gian và thiết bị phù hợp để tập trung làm bài
- 3 Chuẩn bị sẵn dụng cụ cần dùng khi làm bài như bút, nháp, máy tính
- 4 Căn chỉnh thời gian làm từng câu một cách hợp lý
-
Câu 1: Nhận biết
-
Câu 2: Thông hiểuĐể phân biệt but-1-yne và but-2-yne người ta dùng thuốc thử nào sau đây?
Để phân biệt but-1-yne và but-2-yne người ta dùng gung dịch AgNO3/NH3:
- Dung dịch but-1-yne khi phản ứng với AgNO3/NH3 xuất hiện kết tủa vàng:
CH≡C–CH2–CH3 + AgNO3 + NH3 → CAg≡C–CH2–CH3 + NH4NO3
- But-2-yne khi phản ứng không có hiện tượng xảy ra.
-
Câu 3: Thông hiểu
Cho 2-methylpropane tác dụng với chlorine (tỉ lệ mol 1 : 1, có ánh sáng) thu được tối đa bao nhiêu sản phẩm thế monochloro?
Cho 2-methylpropane tác dụng với chlorine (tỉ lệ mol 1 : 1, có ánh sáng) thu được 2 sản phẩm thế monochloro
.

-
Câu 4: Thông hiểu
Bậc của nguyên tử carbon đánh dấu (*) trong hợp chất sau là

Ta có thấy nguyên tử carbon có đánh dấu (*) liên kết trực tiếp với 3 nguyên tử carbon khác.
⇒ Nguyên tử carbon (*) có bậc III.
-
Câu 5: Nhận biết
Hiđro hóa hoàn toàn isopren ta thu được:
CH2=C(CH)3-CH=CH2 + 2H2
CH3-CH(CH3)-CH2-CH3
Isopentan
-
Câu 6: Thông hiểu
Cho các hợp chất sau: CH3CH2CH2CH3 (1), CH3CH(CH3)CH3 (2), CH4 (3), CH3CH2CH3 (4). Dãy các chất được sắp xếp theo thứ tự tăng dần nhiệt độ sôi là:
- Đối với dãy đồng đẳng alkane, nhiệt độ sôi tăng dần theo khối lượng phân tử:
⇒ Nhiệt độ sôi: (3): (4)
- Đối với chất (1) và (2): Đồng phân càng phân nhánh thì nhiệt độ sôi càng thấp.
⇒ Nhiệt độ sôi: (2); (1).
Vậy thứ tự tăng dần nhiệt độ sôi là: (3); (4); (2); (1).
-
Câu 7: Nhận biết
Cho các chất sau: methane, ethylene, acetylene, benzene, toluene và naphthalene. số chất ở thể lỏng trong điều kiện thường là:
Thể khí: methane, ethylene, acetylene.
Thể lỏng: benzene, toluene.
Thể rắn: naphthalene.
-
Câu 8: Thông hiểu
Danh pháp thay thế của alkyne CH≡C-CH2-CH(CH3)-CH3 có tên gọi là:

4-methylpent-1-yne
-
Câu 9: Thông hiểu
Nội dung nào sau đây là không đúng?
Naphthalene không tác dụng được với nước bromine và không làm mất màu dung dịch thuốc tím ở điều kiện thường.
-
Câu 10: Nhận biết
Tên của hợp chất hữu cơ X có công thức cấu tạo như sau là:

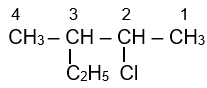
2-chloro-3-methylpentane
-
Câu 11: Nhận biết
Iso-propylbezene còn gọi là:
Iso-propylbezene còn gọi là cumene
-
Câu 12: Vận dụng
Đốt cháy hoàn toàn 31,44 gam hỗn hợp X gồm hai hydrocarbon đồng đẳng liên tiếp cần 87,7566 lít khí O2 (đkc) thu được CO2 và H2O. Vậy công thức phân tử của hai hydrocarbon trong hỗn hợp X lúc đầu là
nO2 = 7,7566 : 24,79 = 3,54 mol
⇒ mO2 = 3,54.32 = 113,28 gam
Gọi x, y là số mol lần lượt của CO2 và H2O.
Áp dụng bảo toàn khối lượng ta có:
44x + 18y = 31,44 + 113,28 (1)
Áp dụng bảo toàn nguyên tố O ta có:
2nCO2 + nH2O = 2nO2
⇒ 2x + y = 3,54.2 = 7,08 (2)
Giải hệ phương trình (1) và (2) ta được:
x = 2,16; y = 2,76
Ta nhận thấy nCO2 < nH2O nên hydrocarbon là alkane.
nX = nH2O - nCO2 = 2,76 - 2,16 = 0,6 mol
Số C trung bình là: nCO2 : nX = 2,16 : 0,6 = 3,6
Vì X gồm hai hydrocarbon đồng đẳng liên tiếp nên công thức của 2 alkane đó là: C3H8 và C4H10.
-
Câu 13: Vận dụng
Dẫn 7,437 lít một alkyne X qua dung dịch AgNO3/NH3 dư thấy thu được 44,1 gam kết tủa. Công thức phân tử của X là:
Phương trình tổng quát:
CnH2n-2 + AgNO3 + NH3 → CnH2n-3Ag + NH4NO3
nX = 7,437 : 24,79 = 0,3 mol
Ta có nkết tủa = nX = 0,3 mol
mkết tủa = 0,3. (14n - 3 + 108) = 44,1 ⇔ 4,2n = 12,6
⇒ n = 3
⇒ Alkyne là C3H4
-
Câu 14: Vận dụng cao
Thực hiện phản ứng phân hủy bằng nhiệt hoàn toàn 0,1 mol hỗn hợp X chứa hai chất là đồng đẳng liên tiếp của anken ta thu được CO2 và H2O có khối lượng hơn kém nhau là 6,76 gam. Tìm công thức phân tử của 2 anken có trong phản ứng?
Đốt cháy hoàn toàn anken thu được số mol CO2 và H2O bằng nhau nên:
Gọi nCO2 = nH2O = x mol
mCO2 – mH2O = 44x – 18x = 6,76 ⇒ x = 0,26 mol
⇒ số C trung bình = 0,26/0,1 = 2,6
⇒ công thức phân tử của 2 anken là C2H4 và C3H6
-
Câu 15: Vận dụng
Đốt cháy 0,13 gam mỗi chất A và B đều thu được 0,01 mol CO2 và 0,09 mol H2O. Tỉ khối hơi của A so với B là 3; tỉ khối của B so với H2 là 13. Công thức của A và B lần lượt là
Theo bài ra ta có: MB = 13.2 = 26 nên B là C2H2.
Mà tỉ khối hơi của A so với B là 3
A là C6H6.
-
Câu 16: Nhận biết
Hydrocarbon nào sau đây trong phân tử chỉ chứa liên kết đơn?
Alkane là những hydrocarbon mạch hở, trong phân tử chỉ có liên kết đơn.
-
Câu 17: Nhận biết
Công thức cấu tạo của gốc isobutyl là:
CH3-CH2-: ethyl
(CH3)2-CH-CH2-: isobutyl
(CH3)2-CH-: isopropyl
CH3-CH(CH3)-CH2-CH2-: isopentyl
-
Câu 18: Vận dụng
Phần trăm khối lượng carbon trong phân tử alkane X bằng 82,76%. Công thức phân tử của X là
Gọi công thức phân tử của alkane là CnH2n+2 (n ≥ 1).
Theo bài ra ta có: Phần trăm khối lượng carbon trong phân tử alkane X bằng 82,76%.
⇒ n = 4
Vậy alkane là (C4H10).
-
Câu 19: Thông hiểu
Chất nào sau đây khi tác dụng với HBr chỉ cho một sản phẩm duy nhất?
Alkene khi cộng HBr cho sản phẩm duy nhất ⇒ Alkene có tính chất đối xứng.
⇒ 2,3-dimethylbut-2-ene thỏa mãn.
Phương trình hóa học:
CH3-C(CH3)=C(CH3)-CH3 + HBr → CH3-CH(CH3)-CBr(CH3)-CH3
-
Câu 20: Nhận biết
Nhận định nào nào sau đây là đúng?
Hydrocarbon không no là những hydrocarbon trong phân tử có chứa liên kết đôi C=C hoặc liên kết ba C≡C hoặc cả hai loại liên kết đó.