Cho phản ứng: CH![]() CH + H2O
CH + H2O ![]() A. Chất A là
A. Chất A là
CHCH + H2O
[CH2=CHOH]
CH3CHO.
Cho phản ứng: CH![]() CH + H2O
CH + H2O ![]() A. Chất A là
A. Chất A là
CHCH + H2O
[CH2=CHOH]
CH3CHO.
Nung một lượng butane trong bình kín (có xúc tác thích hợp) thu được hỗn hợp X gồm alkane và alkene. Tỉ khối của X so với khí hydrogen là 21,75. Thành phần phần trăm thể tích của butane trong X là
MX = 21,75.2 = 43,5. Giả sử số mol hỗn hợp X là 1 mol
C4H10 CnH2n+2 + CmH2m
a a
a mol
Bảo toàn khối lượng ta có:
a = 1 – 0,75 = 0,25 mol
C4H10 dư = 0,75 – 0,25 = 0,5 mol
%VC4H10 (X) = (0,5/1).100% = 50%
Để nhận biết hexan và hex-2-ene ta có thể dùng thuốc thử:
Dẫn 2 chất qua dung dịch nước bromine dư thì
- Hex-2-ene làm mất màu dung dịch nước bromine
C6H12 + Br2 → C6H12Br2
- Hexane không làm mất màu dung dịch bromine.
Sản phẩm chính của phản ứng giữa propyne với HCl tỉ lệ mol 1:2 là:
Quy tắc cộng Markovnikov: Trong phản ứng cộng HX vào hydrocarbon không no, nguyên tử H ưu tiên cộng vào nguyên tử carbon mang liên kết đôi có nhiều hydrogen hơn (bậc thấp hơn) còn nguyên tử X cộng vào nguyên tử carbon mang liên kết đôi chứa ít hydrogen hơn (bậc cao hơn).
Phương trình hóa học:
CH≡C –CH3 + 2HCl ⟶ CH3–CCl2–CH3 (spc).
Chất nào sau đây phản ứng với dung dịch AgNO3 trong NH3 theo tỉ lệ 1 : 2 về số mol?
CH ≡ C − C ≡ CH có hai liên kết ba ở hai đầu mạch nên có thể phản ứng với dung dịch AgNO3 NH3 theo tỉ lệ 1 : 2 về số mol.
Một hỗn hợp X gồm một alkyne A và H2 có thể tích 12,32 lít (đktc) cho qua Ni nung nóng, phản ứng hoàn toàn cho ra hỗn hợp Y có thể tích 5,6 lít (Y có H2 dư). Thể tích của A trong X và thể tích H2 dư (đktc) là
Gọi công thức phân tử của alkyne A là CnH2n-2 (n ≥ 2)
Ta có: nkhí giảm = nH2 pư
Vkhí giảm = VH2 pư = 12,32 − 5,6 = 6,72 lít
VH2 dư = Vhh – VA − VH2 pư
= 12,32 − 3,36 − 6,72
= 2,24 (lít)
Khối lượng ethylene thu được khi đun nóng 184 gam ethanol với H2SO4 đậm đặc, hiệu suất của phản ứng đạt 50% là:
C2H5OH CH2=CH2 + H2O
nCH2=CH2 = nC2H5OH = 4 mol
mCH2=CH2 = 4.28.50% = 56 (gam)
Alkene nào sau đây có đồng phân hình học?
Chất có đồng phân hình học là pent-2-ene: CH3CH=CHCH2-CH3.
Phản ứng của but-1-ene với HCl cho sản phẩm chính là:
CH2=CH-CH2-CH3 + HCl → CH3-CHCl-CH2-CH3 (sản phẩm chính)
Quy tắc Markovnikov: Trong phản ứng cộng HX vào hydrocarbon không no, nguyên tử H ưu tiên cộng vào nguyên tử carbon mang liên kết đôi có nhiều hydrogen hơn (bậc thấp hơn) còn nguyên tử X cộng vào nguyên tử carbon mang liên kết đôi chứa ít hydrogen hơn (bậc cao hơn).
Đốt cháy chất nào sau đây cho nCO2 = nH2O?
C2H4 là alkene, khi đốt cháy sẽ thu được nCO2 = nH2O.
Gốc C6H5-CH2- và gốc C6H5- có tên gọi lần lượt là:
Nạp một hỗn hợp khí có 20% thể tích ankan A (CnH2n+2) và 80% thể tích O2 (dư) vào khí nhiên kế. Sau khi cho nổ rồi cho hơi nước ngưng tụ ở nhiệt độ ban đầu thì áp suất trong khí nhiên kế giảm đi 2 lần. Công thức phân tử của ankan A là:
Hỗn hợp khí có 20% thể tích ankan A và 80% oxi nên:
Giả sử nA = 1 mol nO2 = 4 mol.
CnH2n+2 + (3n+1)/2 O2 nCO2 + (n+1)H2O
Bđ: 1 4
Pư: 1 → (3n+1)/2 → n → (n+1)
Spư: 0 4 - (3n+1)/2 n (n+1)
Sau phản ứng cho hơi nước ngưng tụ nên chỉ có O2 và CO2 gây áp suất lên bình chứa.
nAtrước pư = 5 mol
nA sau pư = 4 – (3n+1)/2 + n = 3,5 – 0,5n
Vì T,V = const nên:
Vậy A là C2H6
Hydrocarbon X cộng HCl theo tỉ lệ mol 1:1 tạo sản phẩm có hàm lượng chlorine là 55,04%. X có công thức phân tử là:
X phản ứng với HCl theo tỉ lệ mol 1:1 nên X có công thức là CnH2n.
Phương trình phản ứng :
CnH2n + HCl CnH2n+1Cl
Theo giả thiết ta có:
n = 2
X là C2H4.
Đốt cháy hoàn toàn 9,2 g một ankyl benzen A thu được 30,8 g CO2. Công thức phân tử của A là:
nCO2 = 0,7 mol
Gọi công thức phân tử của alkylbenzene là CnH2n-6 (n 6)
CnH2n-6 + (3n-3)/2O2 nCO2 + (n - 3)H2O
n = 7
A là C7H8.
Cho hỗn hợp 2 alkane X và Y ở thể khí, có tỉ lệ mol trong hỗn hợp nX : nY = 1:4. Khối lượng phân tử trung bình là 52,4. Công thức phân tử của 2 alkane X và Y lần lượt là:
Gọi công thức tổng quát của hai alkane X và Y lần lượt là CnH2n + 2 và CmH2m + 2
Giả sử: nCnH2n + 2 = 1 mol; nCmH2m + 2 = 4 mol ( do nX : nY = 1:4)
n + 4m = 18
Xét: n = 2 m = 4 (thõa mãn)
Vậy 2 alkane là C2H6 và C4H10.
Alkane có khả năng tham gia phản ứng nào sau đây?
Alkane có khả năng tham gia phản ứng thế halogen.
Công thức cấu tạo nào sau đây có tên gọi là isopentane?
Trùng hợp 5,6 lít C2H4 (đktc), nếu hiệu suất phản ứng là 90% thì khối lượng polymer thu được là:
nC2H4 pu = 0,25.0,9 = 0,225 mol
mpolime = mC2H4 pu = 0,225.28 = 6,3 g
Trong các chất sau:
(1) C4H8 (2) C3H8
(3) CH4 (4) C5H12
(5) C3H6 (6) C2H4
(7) C6H14
Các chất thuộc dãy đồng đẳng của alkane là:
Các chất thuộc dãy đồng đẳng của alkane có công thức chunng là CnH2n+2.
Các chất thõa mãn: (2) C3H8; (3) CH4; (4) C5H12; (7) C6H14.
Alkene A phản ứng hoàn toàn với dung dịch KMnO4 được chất hữu cơ B có MB = 1,81MA. Công thức phân tử của A là:
Gọi công thức phân tử của alkene A là CnH2n; chất hữu cơ B là CnH2n+2O2
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 ↓+ 2KOH
MB = 1,81.MA ⇔ 14n + 34 = 1,81.14n ⇒ n = 3
⇒ Alkene A là C3H6.
Benzene tác dụng với H2 dư có mặt bột Ni xúc tác, thu được
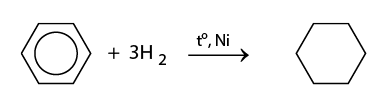
Cyclohexane
Số đồng phân cấu tạo của alkene có cùng công thức phân tử C4H8 là:
Các đồng phân cấu tạo là:
CH2=CH-CH2-CH3
CH3-CH=CH-CH3 (cis – trans)
CH2=C(CH3)- CH3.
Monome của sản phẩm trùng hợp có tên gọi là polyethylene (PE) là:
nCH2=CH2 (-CH2-CH2 -)n
Hỗn hợp A và B là 2 alkene có khối lượng 12,6 gam được trộn theo tỷ lệ cùng số mol hợp tác dụng vừa đủ với 32 gam bromine trong dung dịch. Nếu trộn hỗn hợp theo tỷ lệ cùng khối lượng thì 16,8 gam hỗn hợp tác dụng vừa đủ 0,6 gam H2. Biết MA < MB, A và B lần lượt là:
nBr2 = 0,2.
2 alkene có số mol bằng nhau nên nX = nY = 0,1.
Gọi A, B là khối lượng phân tử của 2 alkene
Ta có:
- Trong hỗn hợp cùng số mol:
(A + B).0,1 = 12,6 (1)
- Trong hỗn hợp cùng khối lượng:
Từ (1) và (2) ta có A = 42; B = 84.
⇒ 2 alkene là C3H6 và C6H12
Để oxi hoá hết 10,6 gam o-xylene (1,2-dimethylbenzene) cần bao nhiêu lít dung dịch KMnO4 0,5M trong môi trường H2SO4 loãng? Giả sử dùng dư 20% so với lượng phản ứng.
5H3C-C6H4-CH3 + 12KMnO4 + 18H2SO4 5HOOC-C6H4-COOH + 6K2SO4 + 12MnSO4 + 28H2O
nKMnO4 = 0,14.1,2 = 0,288 mol
Phần trăm khối lượng carbon trong phân tử alkane Y bằng 83,33%. Công thức phân tử của Y là
Gọi công thức phân tử của ankan Y có dạng CnH2n+2:
n = 5
Công thức phân tử của Y là C5H12.
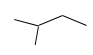
Alkane X có công thức phân tử là C5H12. Chlorine hóa X, thu được 4 sản phẩm dẫn xuất monochloro. Tên gọi của X là:
Alkane C5H12 có 3 đồng phân:
CH3 – CH2 – CH2 – CH2 – CH3: có 2 vị trí thế chlorine
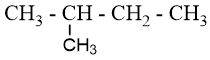 : có 4 vị trí thế chlorine
: có 4 vị trí thế chlorine
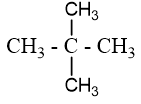 : Có 1 vị trí thế chlorine
: Có 1 vị trí thế chlorine
Đốt cháy hoàn toàn m gam hỗn hợp X gồm CH4, C3H8 và C4H10 thu được 17,6 gam CO2 và 10,8 gam H2O. Giá trị của m là
nCO2 = 0,4 mol; nH2O = 0,6 mol
Áp dụng định luật bảo toàn nguyên tố:
nC = nCO2 = 0,4 mol; nH = 2.nH2O = 1,2 mol
Bảo toàn khối lượng: malkane = mC + mH = 12.0,4 + 1.1,2 = 6 gam
Trong các chất dưới đây, chất nào có nhiệt độ sôi thấp nhất?
Chất có nhiệt độ sôi thấp nhất là methane vì có khối lượng phân tử nhỏ nhất.
Trộn 1 mol alkene X với 1,6 mol H2 rồi dẫn hỗn hợp qua Ni nung nóng thu được hỗn hợp Y. Dẫn hỗn hợp Y vào bromine dư thấy có 0,2 mol Br2 đã phản ứng. Hiệu suất phản ứng hydrogen hóa là
Y phản ứng với dung dịch Br2 alkene dư.
nalkene dư = nBr2 = 0,2 mol
nalkene phản ứng = 1 – 0,2 = 0,8 mol
nalkene = 1 mol < nH2 = 1,6 mol
Hiệu suất phản ứng tính theo alkene.
Điều kiện để alkene có đồng phân hình học là
Cho chất X có công thức cấu tạo:
CH2Cl-CH(CH3)-CH(CH3)-C![]() C-CH3
C-CH3
Quy tắc gọi tên alkyne có mạch nhánh:
Số chỉ vị trí nhánh - tên mạch nhánh (mạch chính) - Số chỉ vị trí liên kết bội - tên hậu tố
Tên gọi của X là 6-chloro-4,5-dimethylhex-2-yne.
Đốt cháy hoàn toàn 8,0 gam hỗn hợp X gồm hai alkyne (thể khí ở nhiệt độ thường) thu được 26,4 gam CO2. Mặt khác cho 8,0 gam hỗn hợp X tác dụng với AgNO3 trong NH3 dư đến khi phản ứng hoàn toàn thu được lượng kết tủa vượt quá 25 gam. Công thức cấu tạo của 2 alkyne trên là?
Bảo toàn C: nC = nCO2 = 0,6 mol
Hai alkyne chỉ tạo nên từ C và H nên:
mX = mC + mH ⇒ mH = 8 – 0,6 .12 = 0,8
⇒ nH = 0,8 mol
Bảo toàn H: nH2O = nH/2 = 0,4 mol
nankin = nCO2 – nH2O = 0,6 – 0,4 = 0,2 mol
⇒ Số C trung bình = 0,6/0,2 = 3
Mặt khác: Ở nhiệt độ thường thường, 2 alkyne tồn tại ở thể khí 2 ankin có số C ≤ 4
⇒ hỗn hợp X gồm C2H2: a mol và C4H6: b mol
mAgC≡CAg = 0,1.240 = 24 gam
Ta có có lượng kết tủa thu được vượt quá 25 gam nên C4H6 cũng tạo kết tủa.
⇒ Công thức cấu tạo của C4H6 là HC≡C-CH2-CH3.
Công thức cấu tạo của gốc isopropyl là:
Công thức cấu tạo của gốc isopropyl là CH3-CH(CH3)-
Hỗn hợp X gồm axetilen và một ankin A, có số mol bằng nhau. Dẫn 2,24 lít hỗn hợp X (đktc) vào dung dịch AgNO3/NH3 lấy dư, sau khi phản ứng xảy ra hoàn toàn thu được 20,05 gam kết tủa vàng. Xác định CTCT của A.
nhh = 2,24/22,4 = 0,1 mol; nC2H2 = nA = 0,05 mol
C2H2 + 2AgNO3 + 2NH3 → Ag2C2 + 2NH4NO3
⇒ nAg2C2 = nC2H2 = 0,05 mol
⇒ mAg2C2 = 0,05.240 = 12 gam < 20,05 gam
⇒ A cũng có phản ứng với AgNO3/NH3:
CnH2n−2 + AgNO3 + NH3 → CnH2n−3Ag + NH4NO3
nCnH2n−3Ag = nCnH2n−2 = 0,05 mol
mCnH2n−3Ag = 20,05 – 12 = 8,05 gam
⇒ MCnH2n−3Ag = 8,05/0,05 = 161 (g/mol)
⇒ 14n + 105 = 161⇒ n = 4
⇒ CTPT của A là: C4H6 mà A có tạo kết tủa với AgNO3 nên A có liên kết ba ở đầu mạch: CH≡C−CH2−CH3
Nhiệt phân methane ở 1500oC trong thời gian rất ngắn, toàn bộ khí sau phản ứng cho qua dung dịch AgNO3 dư trong amoniac thì thu được 24,0 gam kết tủa. Khí thoát ra được đốt cháy hoàn toàn thì thu được 9,0 gam H2O. Tính hiệu suất phản ứng nhiệt phân?
nC2H2 = nC2Ag2 = 24/240 = 0,1 mol
⇒ nCH4 pư = 2.0,1 = 0,2 mol
nH2 = 3.0,1 = 0,3 mol
Đốt cháy khí thoát ra:
Bảo toàn H: nH2O = nH2 + 2.nCH4dư
⇒ nCH4 ban đầu = 0,1 + 0,2 = 0,3 mol
Hỗn hợp X gồm 2 alkene kế tiếp nhau trong dãy đồng đẳng. Đốt cháy hoàn toàn 2,24 lít hỗn hợp X sau đó cho toàn bộ sản phẩm cháy vào 2 lít dung dịch Ca(OH)2 0,125M, thu được 15 gam kết tủa. Công thức của 2 alkene là
nCa(OH)2 = 0,25 mol; nCaCO3 = 0,15 mol
TH1: Ca(OH)2 dư chỉ tạo 1 muối CaCO3.
nCO2 = nCaCO3 = 0,15 mol
số C trung bình = nCO2/nanken = 0,15/0,1 = 1,5 (loại vì alkene có số C luôn ≥ 2)
TH2: Ca(OH)2 hết, thu được 2 muối CaCO3 và Ca(HCO3)2.
Bảo toàn nguyên tố Ca:
nCa(OH)2 = nCacO3 + nCa(HCO3)2 nCa(HCO3)2 = 0,25 – 0,15 = 0,1 mol
Bảo toàn nguyên tố C:
nCO2 = nCaCO3 + 2.nCa(HCO3)2 = 0,15 + 2.0,1 = 0,35 mol
số C trung bình = 0,35/0,1 = 3,5
2 alkene là C3H6 và C4H8.
Khí thiên nhiên được dùng làm nhiên liệu và nguyên liệu cho các nhà máy sản xuất điện, sứ, đạm, methyl alcohol,... Thành phần chính của khí thiên nhiên là
Methane là thành phần chủ yếu của khí thiên nhiên (có trong các mỏ khí).
Để làm sạch ethylene có lẫn acetylene ta cho hỗn hợp đi qua dung dịch nào sau đây?
Hợp chất X có công thức khung phân tử:
Tổng số liên kết ![]() trong phân tử X là
trong phân tử X là
Từ công thức khung phân tử ta tìm được công thức cấu tạo thu gọn của X:
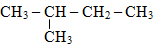
Trong X có 12 liên kết
C-H và 4 liên kết
C – C.
