Chọn câu sai trong các câu sau đây?
Phenol thể hiện tính acid yếu, dung dịch phenol không làm quỳ tím hóa đỏ.
Chọn câu sai trong các câu sau đây?
Phenol thể hiện tính acid yếu, dung dịch phenol không làm quỳ tím hóa đỏ.
Đốt cháy 0,05 mol X dẫn xuất benzene 15,4 gam CO2. Biết 1 mol X phản ứng vừa đủ 1 mol NaOH hay 2 mol Na. X có bao nhiêu công thức cấu tạo thỏa mãn?
nCO2 = 0,35 mol
Bảo toàn nguyên tố C:
1 mol X phản ứng vừa đủ 2 mol Na → X có 2 nhóm OH
1 mol X phản ứng vừa đủ 1 mol NaOH → 1 nhóm OH gắn trực tiếp vào vòng benzene
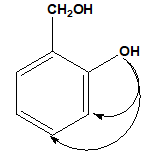
Vậy X có 3 công thức thỏa mãn.
Hợp chất hữu cơ X thuộc phenol, có công thức phân tử C8H10O. Số đồng phân cấu tạo của X là:
Số đồng phân cấu tạo của C8H10O là 9
Cho alcohol có công thức cấu tạo sau:
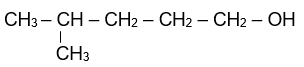
Tên theo danh pháp thay thế của alcohol trên là:

4-methylpentan-1-ol.
Cho phản ứng hóa học sau:
C2H5-Cl + NaOH ![]() C2H5-OH + NaCl.
C2H5-OH + NaCl.
Phản ứng trên thuộc loại phản ứng nào sau đây?
Phản ứng thuộc loại phản ứng tách.
C2H5-Cl + NaOH C2H5-OH + NaCl.
A có công thức phân tử C3H5Br3. A tác dụng với NaOH đun nóng được sản phẩm B vừa có phản ứng với Na, vừa có phản ứng tráng gương. Oxi hóa B bằng CuO thu được tạp chức. Công thức cấu tạo của A là
Công thức cấu tạo của A là CH3-CHBr-CHBr2
CH3-CHBr-CHBr2 + 3NaOH CH3-CH(OH)-CHO + 3NaBr + H2O
CH3-CH(OH)-CHO + Na → CH3-CH(ONa)-CHO + 1/2H2
CH3-CH(OH)-CHO 2Ag↓
CH3-CH(OH)-CHO + CuO CH3-CO-CHO + Cu + H2O
Hỗn hợp Y gồm methanol, ethylene và glycerol. Cho m gam hỗn hợp Y tác dụng với kim loại Na (dư), sau khi phản ứng kết thúc thu được 28,509 lít khí H2 (đkc). Nếu đốt cháy hoàn toàn 2m gam Y thì thu được CO2 và 122,4 gam H2O. Xác định m.
nH2 = 1,15 mol; nH2O = 6,8 mol
Khi hỗn hợp Y tác dụng với Na dư, xảy ra phản ứng thể nguyên tử H của nhóm OH:
-OH + Na → -ONa + H2↑
⇒ nOH = 2nH2 = 2.1,15 = 2,3 (mol)
⇒ nO = 2,3 (mol)
Khi đốt cháy m gam Y thu được nH2O = 3,4 mol ⇒ nH (Y) = 6,8 (mol)
Dễ thấy trong Y có số nguyên tử C bằng số nhóm OH ⇒ nC = 2,3 (mol)
Vậy: mY = mC + mH + mO
= 2,3.12 + 6,8.1 + 2,3.16
= 71,2 gam
Chất X có công thức đơn giản nhất là C2H5O, hoà tan được Cu(OH)2 tạo thành dung dịch màu xanh đậm. Số đồng phân cấu tạo thỏa mãn tính chất của X là
X tác dụng được với dung dịch Cu(OH)2 tạo ra dung dịch màu xanh lam.
⇒ X là alcohol đa chức có ít nhất 2 nhóm –OH kề nhau
⇒ Gọi công thức phân tử X: (C2H5O)n hay C2nH5nOn (5n ≤ 2n + 2)
TH1: n = 2 ⇒ X là C4H10O2.
⇒ Các công thức cấu tạo thỏa mãn: CH2OHCH2OHCH2CH3; CH3CHOHCHOHCH3; CH3CH(OH)(CH3)CH2OH.
TH2: n = 3 ⇒ X là: C6H15O3 (loại vì 15 > 6.2 + 2)
Vậy có 3 công thức cấu tạo thỏa mãn.
Số đồng phân cấu tạo alcohol bậc I có công thức C5H11OH là:
8 đồng phân alcohol trong đó có 4 đồng phân ancol bậc I.
CH3CH2CH2CH2CH2OH
(CH3)2CHCH2CH2OH
(CH3)3CCH2CH2OH
CH3CH2CH(CH3)CH2OH
Chất nào sau đây là dẫn xuất halogen của hydrocarbon?
Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng nguyên tử halogen được dẫn xuất halogen của hydrocarbon
Vậy C6H5-CH2-Cl là dẫn xuất halogen của hydrocarbon.
Phản ứng nào sau đây xảy ra?
Phản ứng xảy ra:
C6H5OH + NaOH C6H5ONa + H2O
Cho dung dịch chứa m gam hỗn hợp gồm phenol (C6H5OH) và acetic acid tác dụng vừa đủ với nước bromine, thu được dung dịch X và 33,1 gam kết tủa 2,4,6-tribromophenol. Trung hòa hoàn toàn X cần vừa đủ 500 ml dung dịch NaOH 1M. Giá trị của m là:
- Hỗn hợp + nước brom:
C6H5OH + 3Br2 → C6H2OHBr3 + 3HBr
CH3COOH + Br2: không xảy ra
Dung dịch X gồm: CH3COOH; HBr
- Dung dịch X + NaOH:
CH3COOH + NaOH → CH2COONa + H2O
HBr + NaOH → NaBr + H2O
Theo đề bài ra: nkết tủa = 33,1/331 = 0,1 (mol) = nphenol; nNaOH = 0,5 .1 = 0,5 (mol)
nHBr = 3.0,1 = 0,3 (mol) nacetic acid = 0,5 – 0,3 = 0,2 mol
mhỗn hợp = 94.0,1 + 60.0,2 = 21,4 (gam)
Chất nào sau đây là dẫn xuất halogen của hydrocarbon?
Khi thay thế nguyên tử halogen của phân tử hydrocarbon bằng nguyên tử halogen được dẫn xuất halogen của hydrocarbon.
⇒ Dẫn xuất halogen của hydrocarbon là CF2=CH–Cl.
Có bao nhiêu hợp chất mạch hở là đồng phân cấu tạo của nhau, có phản ứng với Na, có cùng công thức phân tử là C4H8O?
Hợp chất có công thức phân tử là C4H8O phản ứng với Na alcohol. Các đồng phân mạch hở là:
CH2=CH-CH2-CH2-OH.
CH2=CH-CH(OH)-CH3.
CH3-CH=CH-CH2-OH.
CH2=C(CH3)-CH2-OH.
Khi đốt cháy hoàn toàn m gam hỗn hợp hai alcohol no đơn chức, mạch hở thu được V lít khí CO2 (đktc) và a gam H2O. Biểu thức liên hệ giữa m, a vầ V là
Vì các alcohol là no đơn chức nên:
nO (alcohol) = nalcohol = nH2O - nCO2
Áp dụng định luật bảo toàn khối lượng ta có:
m = malcohol = mC + mH + mO (alcohol)
Một bình kín dung tích 5,6 lít có chứa hỗn hợp hơi của 2 alcohol đơn chức và 3,2 gam O2. Nhiệt độ trong bình là 109,2°C; áp suất trong bình là 0,728 atm. Bật tia lửa điện để đốt cháy hoàn toàn hai alcohol, sau phản ứng nhiệt độ trong bình là 136,5°C và áp suất là p atm. Dẫn các chất trong bình sau phản ứng qua bình (1) đựng H2SO4 đặc (dư), sau đó qua bình (2) đựng dung dịch NaOH (dư), thấy khối lượng bình (1) tăng 1,26 gam, khối lượng bình (2) tăng 2,2 gam. Biết rằng thể tích bình không đổi, p có giá trị là:
Đổi thể tích hỗn hợp khí trong bình trước phản ứng về đktc:
Số mol chất trong bình trước phản ứng là:
2,912/22,4 = 0,13 mol
nO2 = 0,1 mol ⇒ nalcohol = 0,13 – 0,1 = 0,03 mol
Đốt cháy 2 ancol:
nCO2 = 2,2/44 = 0,05 mol; nH2O = 1,26/18 = 0,07 mol
Áp dụng ĐLBTKL:
mO2 dư = mO2 ban đầu + mO(alcohol) – mO(H2O) – mO(CO2)
= 3,2 + 0,03.16 – 0,07.16 – 0,05.32
= 0,96 gam
nO2 dư = 0,96/32 = 0,03 mol
Thể tích của 0,15 mol khí ở đktc:
VO = 0,15.22,4 = 3,36 lít
Sau phản ứng , thể tích thực tế V = 5,6 lít
Tên gọi của dẫn xuất halogen có công thức cấu tạo CH3-CCl(CH3)-CH2-CH3 là:
Tên gọi của dẫn xuất halogen có công thức cấu tạo CH3-CCl(CH3)-CH2-CH3 là 2-chloro-2-methylbutane
Cả phenol và ethyl alcohol đều phản ứng được với
Cả phenol và ethyl alcohol đều phản ứng được với Na:
C6H5OH + Na → C6H5ONa + ½ H2
C2H5OH + Na → C2H5ONa + ½ H2
Người ta có thể điều chế phenol từ Calci carbide theo sơ đồ sau:
CaC2 → X → Y → Z → T → C6H5OH
Hãy chọn X, Y, Z, T phù hợp
Sơ đồ hoàn chỉnh
CaC2 → C2H2 → C6H6 → C6H5Cl→ C6H5ONa→ C6H5OH
Phương trình phản ứng minh họa
CaC2 + 2H2O → C2H2 + Ca(OH)2
CH≡CH C6H6
C6H6 + Cl2 C6H5Cl + HCl
C6H5Cl + 2NaOH ⟶ C6H5ONa + H2O + NaCl
Cho các chất hữu cơ (trong phân tử có chứa vòng benzen) sau:
HO–CH2–C6H4–CH2OH;
CH3–C6H4–OH;
HO–C6H4–OH, C6H5–CH2OH
C2H5–C6H3(OH)2.
Số hợp chất thuộc loại phenol là
Phenol là những hợp chất hữu cơ trong phân tử có một hay nhiều nhóm –OH liên kết trực tiếp với nguyên tử C của vòng benzene.
Hợp chất thuộc loại phenol là: CH3–C6H4–OH, HO–C6H4–OH, C2H5C6H3(OH)2.
Cho các chất: (1) CH3–CH2–OH; (2) CH3–C6H4–OH; (3) CH3–C6H4–CH2–OH; (4) C6H5–OH; (5) C6H5–CH2–OH; (6) C6H5–CH2–CH2–OH.
Dãy chất nào sau đây đều là alcohol thơm?
(1) CH3–CH2–OH không phải là alcohol thơm do không chứa vòng benzene
(2) CH3–C6H4–OH là hợp chất phenol, không phải là alcohol
(3) CH3–C6H4–CH2–OH là alcohol thơm
(4) C6H5–OH là phenol, không phải alcohol
(5) C6H5–CH2–OH là alcohol thơm
(6) C6H5–CH2–CH2–OH là alcohol thơm
Hai alcohol X, Y đều có công thức phân tử C3H8O số alkene thu được khi đun hỗn hợp X và Y với dung dịch H2SO4 đặc ở nhiệt độ cao là
Hai alcohol X, Y đó là:
CH3−CH2−CH2−OH
CH3−CH(OH)−CH3
Hai alcohol trên tách nước đều chỉ cho 1 alkene CH3−CH=CH2
Dung dịch A gồm phenol và cyclohexanol trong hexane (làm dung môi). Chia dung dịch A làm hai phần bằng nhau:
- Phần một cho tác dụng với Na (dư) thu được 4,2143 lít khí H2 (đktc).
- Phần hai phản ứng với nước bromine (dư) thu được 59,58 gam kết tủa trắng.
Khối lượng của phenol và cyclohexanol trong dung dịch A lần lượt là:
Gọi số mol trong dung dịch A là: nC6H5OH = x mol; nC6H11OH = y mol
nH2 = .nC6H5OH +
.nC6H11OH = 0,17 mol
⇒ x + y = 0,34 mol
n↓ = nC6H2OHBr3 = nC6H5OH = 0,18 mol
⇒ x = 0,18 ⇒ y = 0,16
⇒ mphenol = 0,18.94.2 = 33,84 g; mcyclohexanol = 0,16.100.2 = 32 g.
Có bao nhiêu ancol thơm, công thức C8H10O?
Các alcohol thơm thỏa mãn:
C6H5-CH2CH2OH;
C6H5-CH(OH)CH3;
o-CH3-C6H4-CH2OH;
m-CH3-C6H4-CH2OH;
p-CH3- C6H4-CH2OH.
Trong 200 ml rượu vang 12o có bao nhiêu ml ethanol nguyên chất?
Theo bài ra ta có:
Trong 100 ml rượu vang có 12 ml ethanol nguyên chất.
⇒ Trong 200 ml rượu vang có 12.2 = 24 ml ethanol nguyên chất.
Tên quốc tế của hợp chất có công thức CH3CH(C2H5)CH(OH)CH3 là
Chọn mạch C dài nhất, có chứa nhóm -OH làm mạch chính
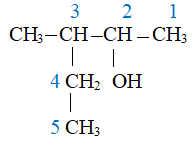
3 - methylpentan - 2 - ol
Dẫn xuất halogen nào sau đây có đồng phân hình học?
Dẫn xuất halogen có đồng phân hình học là CH3CH=CFCH3
Phát biểu nào sau đây không đúng?
Dẫn xuất halogen của hydrocarbon không tan trong nước.
Cho Na tác dụng với ethanol dư sau đó chưng cất đuổi hết ethanol dư rồi đổ nước vào, cho thêm vài giọt quỳ tím thì thấy dung dịch
Phản ứng của ethanol với sodium:
CH3CH2OH (dư) + Na (hết) → CH3CH2ONa + 1/2H2
Sau khi chưng cất đuổi etanol, còn lại CH3CH2ONa, thêm nước vào có phản ứng
CH3CH2ONa + H2O → CH3CH2OH + NaOH
Dung dịch sẽ có màu xanh.
Cho alcohol có công thức cấu tạo sau:
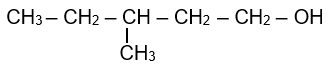
Tên theo danh pháp thay thế của alcohol đó là
Bước 1: Chọn mạch carbon chính là mạch dài nhất, có chứa nhóm – OH.
Bước 2: Đánh số mạch chính sao cho vị trí của nguyên tử carbon liên kết với nhóm hydroxy là nhỏ nhất.
Bước 3: Gọi tên.
+ Tên monoalcohol:
Tên hydrocarbon (bỏ e) - số chỉ vị trí nhóm -OH -ol
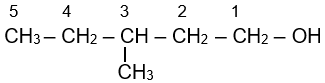
3-methylpentan-1-ol
Chọn mô tả phản ứng sai:
Phenol + dung dịch Br2 → 2,4,6 - tribromphenol + HBr.
Hay: C6H5OH + 3Br2 → C6H2Br3OH↓ + 3HBr.
Pcric acid là 2,4,6 - trinitriphenol được điều chế bằng cách:
C6H5OH + 3HNO3 đặc C6H2(NO2)3OH + 3H2O.
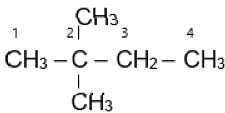
Hợp chất (CH3)3COH có tên thay thế là:
Hợp chất (CH3)3COH có tên thay thế là 2-methylpropan-2-ol
Một dung dịch chứa 6,1 gam chất X là đồng đẳng của phenol đơn chức. Cho dung dịch trên tác dụng với nước bromine dư thu được 17,95 gam hợp chất Y chứa 3 nguyên tử Br trong phân tử. Biết hợp chất này có nhiều hơn 3 đồng phân cấu tạo. Công thức của X là
Gọi a là số mol của X:
X + 3Br2 → Y + 3HBr
a 3a 3a
nBr2 = nHBr = a
Áp dụng ĐLBTKL:
mX + mBr2 = mhợp chất + mHBr
⇒ 6,1 + 160.3a = 17,95 + 81.3a
⇒ a = 0,05 mol
⇒ MX = 6,1/ 0,05 = 122 (g/mol)
⇒ X có thể là C2H5C6H4OH hoặc (CH3)2C6H3OH
Ta có: X có nhiều hơn 3 đồng phân cấu tạo
⇒ X chỉ có thể là (CH3)2C6H3OH.
Công thức của glycerol là
Công thức của glycerol là C3H5(OH)3.
Nhận xét nào sau đây đúng?
Nhận định không đúng là: "Phenol không tan trong nước"
Phenol ít tan trong nước ở điều kiện thường, tan nhiều khi đun nóng.
Dãy sắp xếp các chất có nhiệt độ sôi tăng dần
Tương tác van der Waals ảnh hưởng đến nhiệt độ sôi của các dẫn xuất halogen, từ trái sang, số lượng nguyên tử chlorine tăng làm cho tương tác van der Waals tăng.
Thứ tự nhiệt độ sôi tăng dần theo chiều: CH4 < CH3Cl < CH2Cl2 < CHCl3 < CCl4.
Alcohol no đơn chức tác dụng được với CuO tạo thành aldehyde là:
Alcohol no đơn chức tác dụng được với CuO tạo aldehyde là alcohol bậc I.
Phương trình hóa học tổng quát là:
R-CH2-OH + CuO R-CH=O + Cu + H2O
alcohol bậc 1 aldehyde
Một chai rượu gạo có thể tích 550 mL và có độ rượu là 40o. Số mL ethanol nguyên chất (khan) có trong chai rượu đó là
Ta có:
100 ml rượu gạo có 40 ml ethanol nguyên chất.
550 ml rượu gạo có x ml ethanol nguyên chất.
Thủy phân hoàn toàn m gam dẫn xuất X chứa Chlorine trong dung dịch NaOH thu được 7,4 gam alcohol Y. Đốt cháy hoàn toàn lượng Y tạo thành rồi dẫn sản phẩm qua 1 bình chứa H2SO4 đặc, bình 2 chứa dung dịch nước vôi trong dư thấy khối lượng bình 1 tăng 9,0 gam, bình 2 có 40,0 gam kết tủa. Công thức phân tử của X và giá trị của m lần lượt là:
Đốt cháy alcohol Y thu được sản phẩm cháy gồm CO2 và H2O.
Khối lượng bình 1 tăng là khối lượng của H2O:
Kết tủa ở bình 2 là CaCO3:
nC = nCO2 = nCaCO3 = 4:100 = 0,4 mol
mY = mC + mH + mO
mO = 7,4 – 1.1 – 0,4.12 = 1,6 gam
nO = 0,1 mol
nC : n H : nO = 0,4 : 1 : 0,1 = 4 : 10 : 1
Alcohol Y là C4H10O
X là C4H9Cl
nX = nC4H10O = 0,4:4 = 0,1 mol
m= 0,1.92,5 = 9,25 gam.
Rượu đơn chức no X có phần trăm nguyên tố carbon theo khối lượng là 52,17%. Đặc điểm nào sau đây là đúng khi nói về alcohol X?
Gọi công thức phân tử của A là CnH2n+2O:
Ta có:
n = 2
CH3CH2OH tác dụng với CuO chỉ ra 1 aldehyde là CH3CHO.
