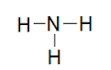
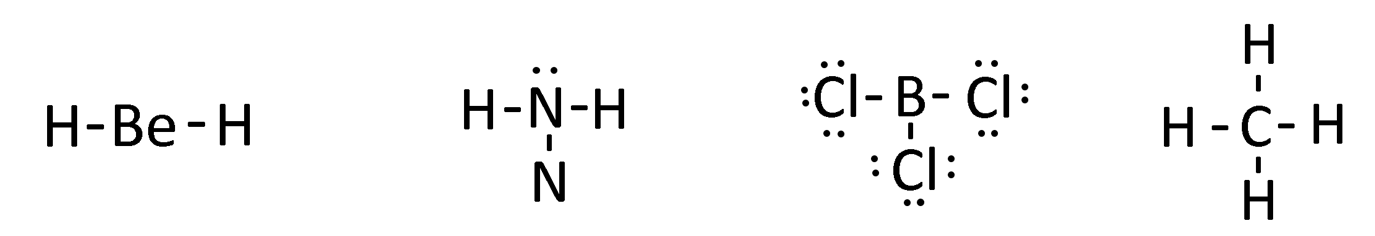- Tìm cation X+:
X+ được tạo thành từ 5 nguyên tử nên: 
 Phải có 1 nguyên tố có số proton bé hơn 2
Phải có 1 nguyên tố có số proton bé hơn 2
 Chỉ có thể là H (do He là khí hiếm)
Chỉ có thể là H (do He là khí hiếm)
Gọi X là AHy theo giả thiết ta có:
)
Vậy X+ là NH4+.
- Tìm anion Y3- :
Tương tự, ta có Y3- cũng được tạo từ 5 nguyên tử của 2 nguyên tố nên: 
Do đó phải có 1 nguyên tố có số proton nhỏ hơn 9,4 (chu kỳ 2 hoặc 1).
Mặt khác theo giả thiết ta có 2 nguyên tố phi kim tạo nên Y thuộc 2 chu kỳ liên tiếp
 Hai nguyên tố đó thuộc chu kỳ 2 và chu kỳ 3.
Hai nguyên tố đó thuộc chu kỳ 2 và chu kỳ 3.
Chu kỳ 3 có các phi kim Si (14); P (15); S (16); 17 (Cl)
Từ đó ta suy ra được các cặp là (Si – N); (P – O); (S – F).
Dễ dàng nhận thấy chỉ có cặp thỏa mãn là (P – O) với ion PO43−
Vậy Z là (NH4)3PO4 từ đó ta có:
- Phân tử khối của Z là 133  Là số lẻ
Là số lẻ
- Trong Z chỉ chứa liên kết ion (giữa NH4+ và PO43-) và liên kết cộng hóa trị (giữa N và H; giữa P và O).
- Z chứa ion nên Z phản ứng được với NaOH theo phương trình.
- Z phản ứng được với AgNO3 tạo kết tủa Ag3PO4 (màu vàng).