Trong mạng tinh thể NaCl, các ion Na+ và Cl– được phân bố luân phiên đều đặn trên các đỉnh của các
Trong mạng tinh thể NaCl, các ion Na+ và Cl– được phân bố luân phiên đều đặn trên các đỉnh của các hình lập phương.
Trong mạng tinh thể NaCl, các ion Na+ và Cl– được phân bố luân phiên đều đặn trên các đỉnh của các
Trong mạng tinh thể NaCl, các ion Na+ và Cl– được phân bố luân phiên đều đặn trên các đỉnh của các hình lập phương.
Số đơn vị điện tích hạt nhân của nguyên tử fluorine là 9. Trong nguyên tử fluorine, số electron ở phân mức năng lượng cao nhất là
Nguyên tử F có điện tích hạt nhân Z = 9.
⇒ Số electron của F là 9.
Cấu hình electron: 1s22s22p5
Vậy số electron ở phân mức năng lượng cao nhất 2p là 5e.
Năng lượng liên kết (Ea) đặc trưng cho điều gì?
Năng lượng liên kết (Ea) đặc trưng cho độ bền liên kết.
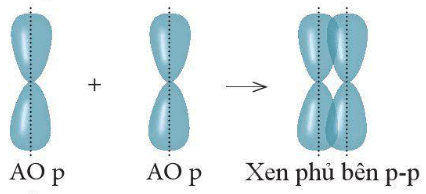
Xen phủ nào sau đây tạo thành liên kết pi (π)?
Liên kết được tạo nên từ xen phủ bên của hai AO p được gọi là liên kết pi (π).
Bán kính nguyên tử của các nguyên tố: P, Cl, Al, Na xếp theo chiều giảm dần là:
Các nguyên tố P, Cl, Al, Na thuộc cùng một chu kì. Mà trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần.
⇒ Bán kính nguyên tử của các nguyên tố: P, Cl, Al, Na xếp theo chiều giảm dần là:
Na, Al, P, Cl.
Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của các lớp thứ nhất, thứ hai, thứ ba, thứ tư lần lượt là
Kí hiệu của các lớp electron thứ nhất, thứ hai, thứ ba, thứ tư lần lượt là M, N, O, P.
Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hydrogen và trong oxide cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
Gọi công thức phân tử của R với H là RHx oxide cao nhất tương ứng có dạng R2O8-x
Ta có: Phần trăm về khối lượng của R trong công thức với Hydrogen và trong công thức oxide cao nhất là:
R là carbon. Oxide cao nhất của C là CO2: O=C=O
Xét các đáp án:
- CO2 là phân tử không phân cực.
- CO2 ở điều kiện thường là chất khí.
- C thuộc chu kì 2
- Carbon (ở trạng thái cơ bản): 6C: 1s22s22p2 có 4 electron s và 2 electron p
Nguyên tử của nguyên tố C có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của X với hydrogen, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxide cao nhất là:
X: ns2np4 ⇒ X thuộc nhóm IVA ⇒ hợp chất khí với H là XH2.
⇒ Oxide của X với hóa trị cao nhất là XO3.
Ta có:
Phần trăm khối lượng của X trong oxide là:
Mô tả sự hình thành ion của nguyên tử S (Z = 16) theo quy tắc octet là
S (Z = 16) có cấu hình electron: 1s22s22p63s23p4 ⇒ Có 6 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ar (Z = 18): 1s22s22p63s23p6
Do đó, S có xu hướng nhận 2 electron để trở thành ion mang điện tích âm.
S + 2e ⟶ S2−
Cặp electron liên kết trong phân tử nào dưới đây không bị lệch về phía nguyên tử nào?
Phân tử H2 được tạo nên tử 2 nguyên tử H, đều có cùng độ âm điện.
Do đó lực hút electron của hai nguyên tử H bằng nhau Phân tử H2 không có cặp electron liên kết bị lệch về phía nguyên tử nào
Nguyên tử của nguyên tố X có tổng số hạt p, n, e là 95; trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Nhận định nào dưới đây về X là không đúng?
Gọi số hạt proton (bằng số hạt electron) trong nguyên tử nguyên tố X bằng Z.
Gọi số hạt neutron trong nguyên tử nguyên tố X bằng N.
Nguyên tử của nguyên tố X có tổng số hạt p, n, e là 95 nên:
2Z + N = 95 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 25 nên:
2Z – N = 25 (2)
Giải hệ (1) và (2) ta có: Z = 30 và N = 35
Vậy:
- X có 30 electron ở lớp vỏ.
- X có 35 hạt neutron (không mang điện).
- Số khối A = Z + N = 65
- Số hạt mang điện của X: 30 + 30 = 60
Hoà tan 13,05 gam hỗn hợp X gồm Na, K, Na2O, CaO vào 200 ml dung dịch HCl 2,5M (vừa đủ), sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y và 0,1 mol khí H2. Tính tổng khối lượng muối chloride thu được khi cô cạn dung dịch Y.
Bảo toàn H: nHCl = 2nH2 + 2nH2O
⇒ Số mol H2O: 0,15 mol
Bảo toàn khối lượng:
13,05 + 0,5.36,5 = mmuối + 0,1.2 + 0,15.18
⇒ mmuối = 28,4 gam
Nếu 4 electron được điền vào 3 AO thì số lượng electron độc thân là
Mỗi AO chứa tối đa 2 electron, như vậy nếu 4 electron được điền vào 3 AO thì sẽ có 1 AO đã chứa đủ electron tối đa, 2 AO chỉ chứa 1 electron (electron độc thân).
Phát biểu nào sau đây không đúng?
Nguyên tử có cấu tạo rỗng,gồm vỏ nguyên tử và hạt nhân nguyên tử.
Nguyên tử Y có xu hướng nhận 3 electron để đạt được lớp electron ngoài cùng bền vững của khí hiếm Ar. Y là
Cấu hình electron của Ar: 1s22s22p63s23p6
Nguyên tử Y có xu hướng nhận 3 electron để đạt được lớp electron ngoài cùng bền vững của khí hiếm Ar nên cấu hình electron của Y là: 1s22s22p63s23p3
⇒ ZY = 15
⇒ Y là phosphorus.
Nicotine có trong thuốc lá, là một chất rất độc, có thể gây nhiễm độc nghiêm trọng và gây tử vong, hấp thụ vào cơ thể qua đường tiêu hóa, hô hấp và da. Người ta đã tính được hút một điếu thuốc lá là tự tước đi của mình 5,5 phút sự sống. Hút thuốc lá làm tăng thêm tỉ lệ tử vong 30 - 38%, chủ yếu là các bệnh gây ung thư, bệnh tắc nghẽn mãn tính... Công thức cấu tạo của nicotine có chứa nguyên tố nitrogen và carbon. Vị trí của nitrogen (7N) trong bảng tuần hoàn là
Cấu hình của nguyên tố nitrogen: 1s22s22p3
- Nitrogen có Z = 7 nên thuộc ô số 7.
- Nitrogen có 2 lớp electron nên thuộc chu kì 2.
- Nitrogen có 5 electron lớp ngoài cùng nên thuộc nhóm VA.
Dãy gồm các chất mà phân tử đều chỉ có liên kết cộng hóa trị phân cực là:
Trong các phân tử O2, O3, Cl2 chỉ có liên kết cộng hóa trị không phân cực.
Điện tích của electron là
Điện tích của electron là -1,602.10-19 C.
Nguyên tử nào sau đây có lớp electron ngoài cùng bền vững nhất?
Lớp electron ngoài cùng bền vững khi bão hòa với 8 electron (trừ He với lớp electron ngoài cùng bão hòa với 2 electron).
Ne (Z = 10) có cấu hình electron: 1s22s22p6, có 8 electron lớp ngoài cùng.
Vậy Ne có lớp electron ngoài cùng bền vững.
Nguyên tử T có 11 proton và 12 neutron. Kí hiệu của nguyên tử T là
Kí hiệu chung của nguyên tử X: , với Z là số hiệu nguyên tử, A là số khối.
Số khối của T là: A = Z + N = 11 + 12 = 23
⇒ Kí hiệu nguyên tử của T là
Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng
Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
Ammonia là một hợp chất vô cơ có công thức phân tử NH3. Ở điều kiện tiêu chuẩn, nó là một chất khí, không màu, có mùi khai, tan nhiều trong nước do hình thành liên kết hydrogen với phân tử nước. Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại tối đa bao nhiêu loại liên kết hydrogen?
Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại 4 loại liên kết hydrogen:
| Kiểu 1 | 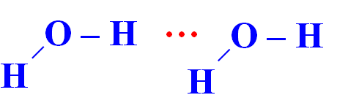 |
| Kiểu 2 | 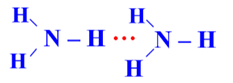 |
| Kiểu 3 | 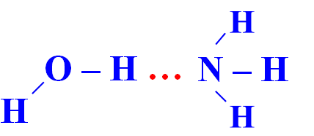 |
| Kiểu 4 | 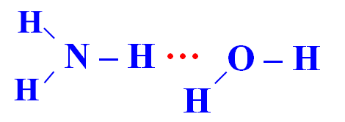 |
Oxide cao nhất của X khi tan trong nước tạo thành dung dịch làm quỳ tím chuyển màu xanh. Tỉ lệ nguyên tử X với oxygen trong oxide cao nhất của X là 1 : 1. X thuộc nhóm
Oxide cao nhất của X khi tan trong nước tạo thành dung dịch làm quỳ tím chuyển màu xanh.
⇒ Oxide cao nhất của X khi tan trong nước tạo thành hydroxide có tính base mạnh.
⇒ X có thể thuộc nhóm IA hoặc IIA.
Tỉ lệ nguyên tử X với oxygen trong oxide cao nhất của X là 1 : 1 ⇒ Oxide cao nhất của X là XO ⇒ hóa trị cao nhất của X là II.
Vậy X thuộc nhóm IIA.
Nguyên tử nguyên tố X có electron cuối cùng thuộc phân lớp s, nguyên tử nguyên tố Y có electron cuối cùng thuộc phân lớp p. Biết rằng tổng số electron trong nguyên tử của X và Y là 20. Bản chất của liên kết hóa học trong hợp chất X – Y là:
X có electron cuối thuộc phân lớp s ⇒ nhóm A (I hoặc II).
Y có electron cuối thuộc phân lớp p ⇒ nhóm A (III → VIII).
eX + eY = 20 ⇒ pX + pY = 20
Ta có: X chỉ có thể là: H (p = 1); He (p = 2); Na (p = 11) và K (p = 19).
⇒ Ta thấy chỉ có Na (p = 11) ⇒ pY = 9 (fluorine) thỏa mãn.
⇒ X - Y: NaF (liên kết ion)
Trong các sản phẩm sau, sản phẩm nào không phải là sản phẩm của hóa học?
Thực phẩm biến đổi gen là sản phẩm của sinh học.
Nguyên tố H có 2 đồng vị là 1H và 2H, nguyên tố O có 3 đồng vị là 16O, 17O và 18O. Hỏi có bao nhiêu loại phân tử H2O có thể được tạo thành?
Công thức phân tử của nước là H2O.
Có 3 cách ghép 2 đồng vị của hydrogen để tạo H2 (đó là 2 đồng vị 1H, 2 đồng vị 2H, 1 đồng vị 1H và 1 đồng vị 2H).
Với mỗi phân tử H2 tạo thành lại có 3 cách ghép với 1 đồng vị của O để tạo 1 nước.
Vậy tạo được 3 + 3 + 3 = 9 loại phân tử nước.
Chlorine có hai đồng vị bền là 35Cl và 37Cl. Nguyên tử khối trung bình của chlorine là 35,45. Tỉ lệ phần trăm số nguyên tử của 35Cl và 37Cl trong tự nhiên là
Đặt phần trăm số nguyên tử của đồng vị 35Cl là x.
Đặt phần trăm số nguyên tử của đồng vị 37Cl là y.
Ta có: x + y = 100 (1)
Nguyên tử khối trung bình của chlorine là:
(2)
Giải hệ (1) và (2) ta được: x = 77,5 và y = 22,5
Vậy phần trăm số nguyên tử của đồng vị: 35Cl là 77,5%
Phần trăm số nguyên tử của đồng vị 37Cl là 22,5%
⇒ Tỉ lệ phần trăm số nguyên tử của 35Cl và 37Cl trong tự nhiên là:
x : y = 77,5 : 22,5 = 31 : 9
Cho các nguyên tố X (Z = 9), Y (Z = 15), R (Z = 16) và M (Z = 19). Độ âm điện nguyên tử các nguyên tố tăng dần theo thứ tự là
Y (Z = 9) → Y là F: 1s22s22p5 → F thuộc chu kì 2, nhóm VIIA
M (Z = 15) → M là P: 1s22s22p63s23p3 → P thuộc chu kì 3, nhóm VA
X (Z = 16) → X là S: 1s22s22p63s23p4 → S thuộc chu kì 3, nhóm VIA
R (Z = 19) → Z là K: 1s22s22p63s23p64s1 → K thuộc chu kì 4, nhóm IA
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần.
⇒ Độ âm điện: Cl (Z = 17) > S > P > Na (Z = 11)
Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần.
⇒ Độ âm điện: F > Cl (Z = 17); Na (Z =11) > K
Như vậy độ âm điện: K < P < S < F.
Nguyên tử nguyên tố X có phân lớp electron ngoài cùng là 3p4. Công thức oxide ứng với hóa trị cao nhất của X, hydroxide tương ứng và tính acid – base của chúng là
Nguyên tử nguyên tố X có phân lớp electron ngoài cùng là 3p4
⇒ Cấu hình electron đầy đủ của X là: 1s22s22p63s23p4
⇒ X thuộc nhóm VIA
⇒ Hóa trị cao nhất trong hợp chất oxide và hydroxide của X là 6.
⇒ Công thức oxide ứng với hóa trị cao nhất của X là XO3 (có tính acid) và hydroxide là
H2XO4 (có tính acid).
Cho nguyên tử X có tổng số hạt là 34, trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện. Xác định số khối X.
Nguyên tử có tổng số hạt là 34.
⇒ p + n + e = 34
Mà số p = số e
⇒ 2p + n = 34 (1)
Số hạt mang điện gấp 1,8333 lần số hạt không mang điện.
⇒2p = 1,8333n (2)
Từ (1) và (2) ⇒ p = 11, n = 12
⇒ Số khối A = 11 + 12 = 23
Nguyên tử C và H trong các hydrocarbon nào dưới đây không thỏa mãn quy tắc octet? Biết rằng mỗi gạch (−) trong công thức biểu diễn 2 electron hóa trị chung.
- Xét H – C ≡ C – H
Mỗi nguyên tử C có 4 gạch (−) xung quanh ⇒ có 4 đôi electron chung xung quanh ⇒ có 8 electron ở lớp vỏ ngoài cùng ⇒ đạt cấu hình electron bền vững của khí hiếm.
Mỗi nguyên tử H có 1 gạch (−) xung quanh ⇒ có 1 đôi electron chung xung quanh ⇒ có 2 electron ở lớp vỏ ngoài cùng ⇒ đạt cấu hình electron bền vững của khí hiếm He.
⇒ Công thức H – C ≡ C – H thỏa mãn quy tắc octet.
- Xét H2C = CH2
Mỗi nguyên tử C có 4 gạch (−) xung quanh (2 gạch giữa C với C và 2 gạch với H) ⇒ có 4 đôi electron chung xung quanh ⇒ có 8 electron ở lớp vỏ ngoài cùng ⇒ đạt cấu hình electron bền vững của khí hiếm.
Mỗi nguyên tử H có 1 gạch (−) xung quanh ⇒ có 1 đôi electron chung xung quanh ⇒ có 2 electron ở lớp vỏ ngoài cùng ⇒ đạt cấu hình electron bền vững của khí hiếm He.
⇒ Công thức H2C = CH2 thỏa mãn quy tắc octet.
- Xét H3C – CH3
Mỗi nguyên tử C có 4 gạch (−) xung quanh (1 gạch giữa C với C và 3 gạch với H) ⇒ có 4 đôi electron chung xung quanh ⇒ có 8 electron ở lớp vỏ ngoài cùng ⇒ đạt cấu hình electron bền vững của khí hiếm.
Mỗi nguyên tử H có 1 gạch (−) xung quanh ⇒ có 1 đôi electron chung xung quanh ⇒ có 2 electron ở lớp vỏ ngoài cùng ⇒ đạt cấu hình electron bền vững của khí hiếm He.
⇒ Công thức H3C – CH3 thỏa mãn quy tắc octet.
- Xét CH3
Mỗi nguyên tử C có 3 gạch (−) xung quanh (3 gạch với H) ⇒ có 3 đôi electron chung xung quanh ⇒ có 6 electron ở lớp vỏ ngoài cùng ⇒ không đạt cấu hình electron bền vững của khí hiếm.
Mỗi nguyên tử H có 1 gạch (−) xung quanh ⇒ có 1 đôi electron chung xung quanh ⇒ có 2 electron ở lớp vỏ ngoài cùng ⇒ đạt cấu hình electron bền vững của khí hiếm He.
⇒ Công thức CH3 không thỏa mãn quy tắc octet.
A, B là 2 kim loại nằm ở hai chu kì liên tiếp thuộc nhóm IIA. Cho 4,4 gam một hỗn hợp gồm A và B tác dụng với HCl 1M (dư) thu được 3,7185 lít khí (đkc). Hai kim loại A và B lần lượt là
Gọi công thức chung của hai kim loại là M
M + 2HCl → MCl2 + H2
nM = nH2 = 0,15
Ta có: MA = 4,4 ⇒ M = 4,4/0,15 = 29,33
A và B là 2 kim loại nằm ở 2 chu kì liên tiếp thuộc nhóm IIA nên A là Mg và B là Ca.
Khí hiếm nào sau đây có nhiệt độ nóng chảy cao nhất?
Theo chiều tăng dần của điện tích hạt nhân nguyên tử trong nhóm VIIIA (nhóm khí hiếm), bán kính nguyên tử tăng đồng thời khối lượng nguyên tử tăng.
⇒ Tương tác van der Waals tăng ⇒ Nhiệt độ nóng chảy tăng.
⇒ Khí hiếm có nhiệt độ nóng chảy cao nhất trong dãy là Xe.
Trong các phân tử hợp chất ion sau đây: CaCl2, MgO, CaO, Ba(NO3)2, Na2O, KF, Na2S, MgCl2, K2S, KCl có bao nhiêu phân tử được tạo thành bởi các ion có chung cấu hình electron 1s22s22p63s23p6?
Để tạo thành cấu hình electron 1s22s22p63s23p6 thì:
- Kim loại chu kì 4 cho 1, 2, 3 electron để trở về cấu hình bền
- Phi kim chu kì 3 nhận thêm electron để tạo thành cấu hình bền
Các hợp chất tạo bởi kim loại chu kì 4 và phi kim chu kì 3 là: CaCl2, K2S, KCl
Hợp chất nào dưới đây có chứa đồng thời cả liên kết cộng hóa trị và liên kết ion?
Có 2 liên kết ion giữa Na và O, có 2 liên kết cộng hóa trị giữa S và O, có hai liên kết cho nhận giữa S và O.
Nguyên tố R thuộc nhóm IIA của bảng tuần hoàn. Công thức oxide cao nhất của R là
Vì R thuộc nhóm IIA nên công thức oxide cao nhất của R là RO.
Calcium là nguyên tố rất thiết yếu cho sự sống. Trong cơ thể thì có đến 98% calcium nằm ở xương và răng, 2% còn lại là các ion nằm trong máu để thực hiện các chức năng thần kinh cơ và đông máu. Calcium trong bảng tuần hoàn nguyên tố có ký hiệu Ca và số hiệu nguyên tử bằng 20. Cấu hình electron của nguyên tử calcium là
Số hiệu nguyên tử của Ca bằng 20 ⇒ Cấu hình electron của calcium là:
1s22s22p63s23p64s2.
Tính acid của các hydroxide các nguyên tố xếp theo thứ tự tăng dần là
Xu hướng biến đổi tính acid, tính base của hydroxide: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
⇒ Tính acid của các hydroxide các nguyên tố xếp theo thứ tự tăng dần là:
H2SiO3 < H3PO4 < H2SO4 < HClO4.
Các nguyên tố hóa học ở nhóm IIA trong bảng tuần hoàn thuộc khối các nguyên tố
Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA, được gọi là nhóm kim loại kiềm và nhóm IIA, được gọi là nhóm kim loại kiềm thổ.
Trong một nhóm A, trừ nhóm VIIIA, theo chiều tăng của điện tích hạt nhân nguyên tử thì
Trong một nhóm A, trừ nhóm VIIIA, theo chiều tăng của điện tích hạt nhân nguyên tử thì tính phi kim giảm dần, bán kính nguyên tử tăng dần.
