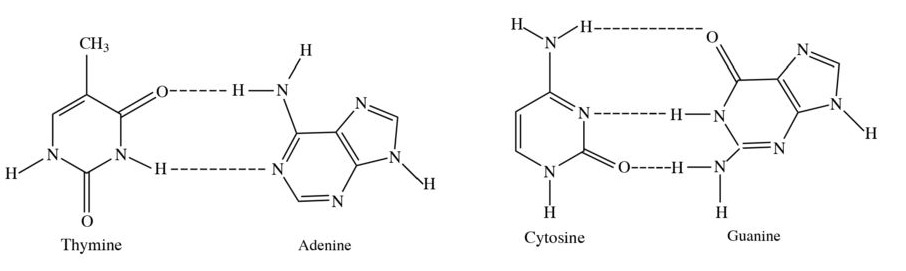
Na (Z = 11): 1s22s22p63s1 ⇒ Ô số 11, chu kì 3, nhóm IA
Al (Z = 13): 1s22s22p63s23p1 ⇒ Ô số 13, chu kì 3, nhóm IIIA
Cl (Z = 17): 1s22s22p63s23p5 ⇒ Ô số 17, chu kì 3, nhóm VIIA
Nhận thấy cả 3 nguyên tố đều cùng thuộc chu kì 3 nhưng khác nhóm.
Trong một chu kì theo chiều tăng dần điện tích hạt nhân:
- Độ âm điện tăng dần ⇒ Thứ tự tăng dần về độ âm điện là: Na < Al < Cl.
- Bán kính nguyên tử giảm dần ⇒ Thứ tự giảm dần về bán kính nguyên tử là Na: > Al > Cl.
- Tính base của các oxide giảm dần ⇒ Thứ tự tăng dần về tính base là Cl2O7 < Al2O3 <Na2O.
- Tính acid của hydroxide tăng dần ⇒ Thứ tự tăng dần về tính acid là NaOH < Al(OH)3 < HClO4.
cấu hình của X: 1s22s22p63s23p5 (Cl)
cấu hình của Y: 1s22s22p63s1 (Na)