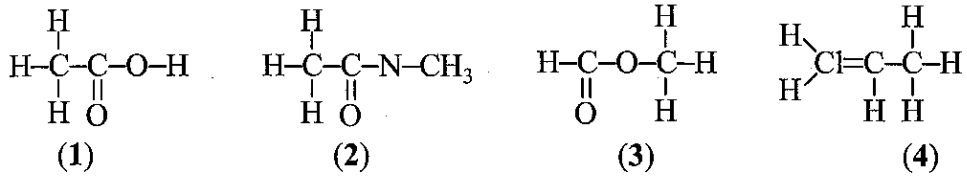Nội dung nào sau đây đúng khi nói về nitric acid?
Dung dịch nitric acid tinh khiết là chất lỏng không màu.
Nitric acid tinh khiết kém bền, bị phân hủy một phần giải phóng khí nitrogen dioxide ngay ở điều kiện thường khi có ánh sáng.
Nitric acid có tính oxi hóa mạnh có thể ăn mòn được hầu hết kim loại trừ Au và Pt
Nitric acid là một acid mạnh, trong dung dịch loãng phân li hoàn toàn.