Sulfur thể hiện tính khử trong phản ứng
Sulfur thể hiện tính khử khi nhường electron:
Sulfur thể hiện tính khử trong phản ứng
Sulfur thể hiện tính khử khi nhường electron:
Phản ứng nhiệt phân nào sau đây không đúng?
Phản ứng nhiệt phân không đúng: NH4NO3 NH3 + HNO3.
Viết đúng: NH4NO3 N2O + 2H2O
Chọn phương trình phản ứng đúng của thí nghiệm sau:
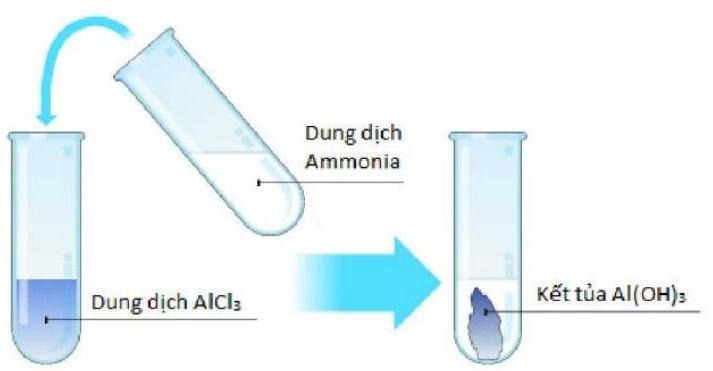
Phương trình phản ứng đúng của thí nghiệm là
AlCl3(aq) + 3NH3(aq) + 3H2O(l) → Al(OH)3(s) + 3NH4Cl(aq).
Sulfur được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da. Tên gọi dân gian của sulfur là
Sulfur (lưu huỳnh) còn được gọi là lưu hoàng, sinh diêm vàng, diêm sinh đã được biết đến từ thời cổ đại.
Cặp chất nào dưới đây là đồng phân loại nhóm chức
Cặp chất nào dưới đây là đồng phân nhóm chức là: CH3COOH và HCOOCH3
Cặp chất nào sau đây không phải là đồng đẳng của nhau?
Những hợp chất hữu cơ được gọi là đồng đẳng khi chúng có thành phần phân tử hơn kém nhau một hoặc nhiều nhóm CH2 và có tính chất hóa học tương tự nhau.
⇒ Cặp chất: CH3-CH3, CH3-CH=CH2 không phải là đồng đẳng.
Trong công nghiệp, sulfuric acid chủ yếu được sản xuất bằng phương pháp tiếp xúc, đi từ nguyên liệu chính là quặng sulfur hoặc quạng pyrite. Tính khối lượng pyrite (chứa 80% FeS2) cần dùng để sản xuất 1 tấn dung dịch H2SO4 49% (biết hiệu suất của cả quá trình là 70%)?
Ta có sơ đồ sản xuất H2SO4:
FeS2 → 2SO2 → 2SO3 → 2H2SO4
mol: 2500 ← 5000
Hiệu suất của cả quá trình là 70% nên lượng FeS2 thực tế cần dùng là:
Khối lượng pyrite (chứa 80% FeS2) cần dùng là:
Nhờ tạo được liên kết hydrogen với nước nên ammonia có tính chất nào sau đây?
Nhờ tạo được liên kết hydrogen với nước nên ammonia tan tốt trong nước.
Để xác định lại nồng độ dung dịch H2SO4 sau khi pha, người ta lấy 10 mL dung dịch này rồi chuẩn độ bằng dung dịch NaOH 0,1 M. Sau 3 lần chuẩn độ, thể tích trung bình của dung dịch NaOH đã dùng là 9,85 mL. Nồng độ dung dịch đã pha gần nhất với
nNaOH = 0,1. 9,85.10−3 = 9,85.10−4 mol
H2SO4 + 2NaOH → Na2SO4 + H2O
Ta có: 2.VNaOH.CM NaOH = VH2SO4.CM H2SO4
⇒ 2.9,85.10−4 = 10−2. CM H2SO4
⇒ CM H2SO4 = 0,197 M
Vậy, nồng độ dung dịch đã pha gần nhất với 0,198 M.
Hợp chất hữu cơ nào sau đây thể hiện tính chất hóa học đặc trưng của nhóm chức Aldehyde?
| Loại hợp chất | Nhóm chức | Ví dụ |
| Alcohol | -OH | C2H5OH |
| Aldehyde | -CHO | CH3CHO |
| Carboxylic acid | COOH- | CH3COOCH3 |
| Amine | -NH2 | CH3NH2 |
| Ester | -COO- | CH3COOCH3 |
| Ether | -O- | CH3OCH3 |
Hợp chất hữu cơ CH3CH2CHO thể hiện tính chất hóa học đặc trưng của nhóm chức Aldehyde (-CHO).
Tiến hành sục khí SO2 vào dung dịch H2S thì có hiện tượng gì xảy ra?
Khi sục khí SO2 vào dung dịch H2S thì dung dịch bị vẩn đục màu vàng do S sinh ra:
SO2 + 2H2S → 3S + 2H2O
Hãy cho biết dãy các dung dịch nào sau đây có khả năng đổi màu quỳ tím sang đỏ (hồng) ?
Các dung dịch có khả năng làm đổi màu quỳ tím sang đỏ (hồng) khi có môi trường acid.
Các dung dịch thỏa mãn là: NaHSO4, HCl và AlCl3.
Cho các phát biểu sau:
1. Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau.
2. Phản ứng bất thuận nghịch là phản ứng xảy ra theo 1 chiều xác định
3. Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
4. Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
5. Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại.
Các phát biểu sai là:
1. đúng
2. đúng
3. sai, cân bằng hóa học là phản ứng hóa học được cân bằng khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
4. đúng
5. sai, phản ứng vẫn xảy ra nhưng tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Vậy ý 3, 5 sai.
Xét cân bằng sau diễn ra trong một piston ở một nhiệt độ không đổi:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Nếu nén piston thì cân bằng chuyển dịch theo chiều nào?
Khi nén piston (tăng áp suất) cân bằng sẽ chuyển dịch theo chiều làm giảm áp suất, tức chiều làm giảm số mol khí hay chiều thuận.
Chất nào sau đây có công thức phân tử trùng với công thức đơn giản nhất?
Chất có công thức phân tử trùng với công thức đơn giản nhất là C2H5OH.
Công thức phân tử trùng với công thức đơn giản nhất đều là: C2H6O
Đun nóng m1 gam bột iron với m2 gam bột sulfur (không có không khí), sau một thời gian thu được hỗn hợp chất rắn X. Cho X tác dụng với dung dịch hydrochloric acid (dư) thu được 12,395 lít hỗn hợp khí Y (đkc) và 2 gam chất rắn Z. Tỉ khối hơi của Y so với hydrogen là 10,6. Giá trị m1 và m2 là:
Phương trình hóa học:
S + Fe → FeS (1)
FeS + 2HCl → FeCl2 + H2S (2)
Fe(dư) + 2HCl → FeCl2 + H2 (3)
Chất rắn không tan là S (dư)
khí Y gồm H2S (x mol) và H2 (y mol) có:
Theo phương trình (1), (2), (3) ta có:
nFe ban đầu = x + y = 0,5 (mol) ⇒ m1 = 0,5.56 = 28 (gam)
nS phản ứng = x = 0,3 mol ⇒ m2 = 0,3.32 + 2 = 11,6 (gam)
Cho phản ứng: H2(g) + I2(g) ⇄ 2HI(g).
Ở nhiệt độ 430oC hằng số cân bằng KC của phản ứng trên bằng 53,96. Đun nóng một bình kín dung tích không đổi 10 lít chứa 4,0 gam H2 và 406,4 gam I2. Khi hệ phản ứng đạt trạng thái cân bằng ở 430oC, nồng độ của HI là:
Từ phản ứng: H2(g) + I2(g) ⇄ 2HI(g)
Ta có hằng số cân bằng:
Gọi a là nồng độ của I2 đã phản ứng, theo (1) ta có:
[I2] khi đạt tới cân bằng là:
[H2] khi đạt tới cân bằng là:
[HI] sinh ra là 2a
Vậy ta có:
⇔ a = 0,1375
Suy ra [HI] = 2a = 0,27
Xét phản ứng quang hợp:
6CO2 + 6H2O ![]() C6H12O6 + 6O2
C6H12O6 + 6O2
Chất nào trong phản ứng này thuộc loại hợp chất hữu cơ?
Chất thuộc loại chất hữu cơ trong phản ứng là: C6H12O6
Cách thực hiện nào sau đây có thể phân biệt được cốc nước cất và cốc nước muối?
Muối ăn là chất khó bay hơi, nước cất dễ bay hơi. Để phân biệt cốc đựng nước cất và cốc đựng nước muối ta tiến hành như sau: Lấy mỗi cốc một ít làm mẫu thử sau đó đem cô cạn, mẫu thử nào đem cô cạn thu được cặn là mẫu thử của cốc chứa nước muối.
Cặp chất nào sau đây là đồng phân của nhau?
Cặp chất là đồng phân là CH3OCH3 và CH3 CH2OH vì có cùng công thức phân tử C2H6O.
Sau khi chưng cất tinh dầu sả bằng hơi nước, thu được một hỗn hợp gồm lớp tinh dầu nổi trên lớp nước. Dùng phương pháp nào sau đây để tách riêng được lớp tinh dầu khỏi lớp nước?
Dùng phương pháp chiết (lỏng - lỏng) để tách riêng được lớp tinh dầu khỏi lớp nước.
Tại khu vực ô nhiễm, pH của nước mưa đo được là 4,5 còn pH của nước mưa tại khu vực không bị ô nhiễm là 5,7. Nhận xét nào sau đây không đúng?
Vì pH của nước mưa bị ô nhiễm thấp hơn pH của nước mưa không bị ô nhiễm nên nồng độ H+ trong nước mưa bị ô nhiễm cao hơn trong nước mưa không bị ô nhiễm. Vậy nồng độ ion OH− trong nước mưa bị ô nhiễm thấp hơn so với trong nước mưa không bị ô nhiễm.
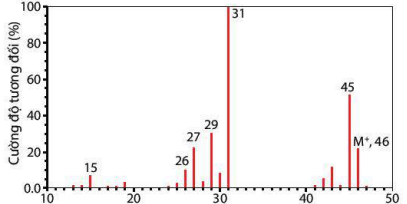
Phổ khối lượng của hợp chất hữu cơ X được cho như hình vẽ bên dưới:
 |
| m/z |
Phân tử khối của hợp chất hữu cơ X là
Quan sát phổ khối lượng ta thấy, mảnh ion phân tử ứng với tín hiệu có giá trị m/z lớn nhất là 46.
Phân tử khối của hợp chất hữu cơ là 46.
Theo thuyết Bronstes - Lowry, H2O đóng vai trò gì trong phản ứng sau?
S2−+ H2O ![]() HS− + OH−
HS− + OH−
H2O nhường H+ cho S2− để tạo thành HS− nên H2O đóng vai trò acid theo thuyết Bronsted – Lowry.
Thể tích dung dịch Ba(OH)2 0,025M cần cho vào 100 ml dung dịch hỗn hợp gồm HNO3 và HCl có pH = 1, để thu được dung dịch có pH = 2 là:
pH = 1 ⇒ [H+] = 10-1 ⇒ nH+ = 0,01 mol
pH sau = 2 < 7 ⇒ môi trường acid ⇒ H+ dư
Ta có:
⇒ 0,01 − 0,05 V = 0,001 + 0,01V
⇒ 0,06 V = 0,009
⇒ V = 0,15 (lít)
Để điều chế 4 lít NH3 từ N2 và H2 với hiệu suất 50% thì thể tích H2 cần dùng ở điều kiện là bao nhiêu?
N2 + 3H2 2NH3
Theo PTHH: VH2 = VNH3 = 6 lít
Do hiệu suất 50% nên:
Úng dụng nào sau đây không phải của nitrogen?
Ứng dụng không phải của nitrogen là sản xuất phân lân.
Phương trình điện li nào sau đây viết sai?
Phương trình điện li viết sai là: Al(OH)3 → Al3+ + OH3–.
Điện tích của nhóm OH là –1.
⇒ Viết đúng: Al(OH)3 Al3+ + 3OH–.
Chất nào sau đây được dùng làm chất phụ gia để làm đông các sản phẩm như đậu hũ, đậu non…?
Calcium sulfate (BaSO4) được dùng trong sản xuất vật liệu xây dựng, làm chất phụ gia để làm đông các sản phẩm như đậu hũ, đậu non,...
Oleum (H2SO4.nSO3) là sản phẩm tạo thành khi cho H2SO4 98% hấp thụ SO3.
Công thức hoá học nào sau đây không phù hợp với thuyết cấu tạo hoá học?
Trong hợp chất hữu cơ O mang hóa trị II.
Hợp chất không phù hợp với thuyết cấu tạo hoá học là: CH3–O=CH–CH3.
Chất hữu cơ X được sử dụng khá rộng rãi trong ngành y tế với tác dụng chống vi khuẩn, vi sinh vật. Kết quả phân tích của nguyên tố X như sau: 52,17% C; 13,04% H về khối lượng, còn lại là oxygen. Phân tử khối của X được xác định thông qua kết quả phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất bằng 46. Công thức phân tử của X là
%mO = 100% - 52,17% - 13,04% = 34,79%.
Đặt công thức phân tử của X là: CxHyOz.
Từ phổ khối lượng của X xác định được MX = 46.
⇒ Công thức phân tử của X là: C2H6O.
Cho các phản ứng sau :
(1) N2 + O2 ⇋ 2NO
(2) N2 + 3H2 ⇋ 2NH3
Trong hai phản ứng trên thì nitrogen
Ta có, số oxi hóa của nitrogen trong hai phản ứng:
Nguyên tử nguyên tố N trong phân tử N2 ở phản ứng (1) nhường electron
⇒ N2 thể hiện tính khử
Nguyên tử nguyên tố N trong phân tử N2 ở phản ứng (2) nhận electron
⇒ N2 thể hiện tính oxi hóa.
Cho bộ dụng cụ chưng cất (được mô tả như hình vẽ sau). Phương pháp chưng cất thường dùng để:
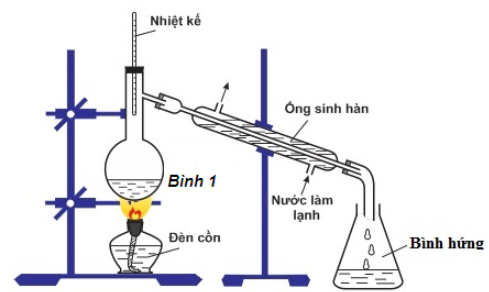
Quan sát ta thấy có nhiệt kế cắm trên thành bình chưng cất ⇒ bộ dụng cụ chưng cất trên thường dùng đề tách các chất lỏng có nhiệt độ sôi khác nhau (nhiệt kế giúp kiểm soát nhiệt độ trong quá trình đun)
Vì sao nitrogen lỏng có thể được sử dụng để làm lạnh nhanh?
Nitrogen lỏng có thể được sử dụng để làm lạnh nhanh vì nitrogen hóa lỏng ở nhiệt độ rất thấp (-196oC).
Phổ hồng ngoại là phương pháp vật lí rất quan trọng và phổ biến để nghiên cứu về
Phổ hồng ngoại là phương pháp vật lí rất quan trọng và phổ biến để nghiên cứu về cấu tạo phân tử hợp chất hữu cơ.
Một dung dịch X thu được bằng cách thêm 50,0 ml dung dịch HBr 0,050 M vào 150,0 ml dung dịch HI 0,100 M. Tính nồng độ H+ của dung dịch X. Biết HBr và HI đều được coi là acid mạnh.
Số mol H+ trong 50 ml HBr là: 0,05.0,050 = 2,5.10-3 (mol).
Số mol H+ trong 150 ml HI là: 0,15.0,100 = 1,5.10-2 (mol).
Nồng độ H+ của dung địch X là:
Không khí bị ô nhiễm sulfur dioxide có khả năng gây nên mưa acid. Trong thành phần của loại mưa này chứa
Trong thành phần của mưa acid chứa sulfuric acid.
Nhận định nào sau đây đúng về nitric acid?
- Nitric acid tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, sôi ở 86oC.
- Nitric acid tan trong nước theo bất kì tỉ lệ nào.
Công thức dạng khung phân tử của chất Y có công thức cấu tạo đầy đủ như sau là:
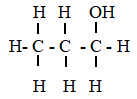
| Công thức cấu tạo đầy đủ | Công thức cấu tạo thu gọn | Công thức khung phân tử |
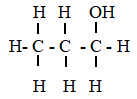 |
CH3-CH2-CH2-OH |
|
