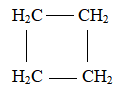
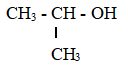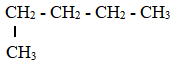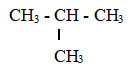Khi tách và tinh chế chất lỏng dựa trên sự khác nhau về nhiệt độ sôi của các chất trong hỗn hợp ở áp suất nhất định, người ta thường sử dụng phương pháo nào sau đây?
Chưng cất là phương pháp tách và tinh chế chất lỏng dựa trên sự khác nhau về nhiệt độ sôi của các chất trong hỗn hợp ở áp suất nhất định.