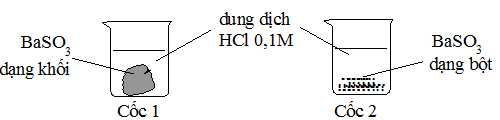
Cl2 có thể oxi hóa được Br- thành Br2 tính oxi hóa của Cl2 mạnh hơn Br2.
Dung dịch HF được dùng để khắc chữ vẽ hình lên thủy tinh nhờ phản ứng với chất nào sau đây?
Acid hydrofloric acid có khả năng hoàn tan silicon dioxide nên được sử dụng để khắc các chi tiết lên thủy tinh theo phản ứng:
HF + SiO2 → SiF4 + 2H2O