Phương trình hóa học nào sau đây không đúng?
2Fe + 3Cl2 2FeCl3.
Phương trình hóa học nào sau đây không đúng?
2Fe + 3Cl2 2FeCl3.
Cho quá trình ![]() , đây là quá trình
, đây là quá trình
Quá trình là quá trình nhường electron nên là quá trình oxi hóa.
Điều nào sau đây đúng khi nói về cấu tạo của phân tử hydrogen halide HX với X là các halogen?
- Phân tử HX gồm một liên kết cộng hóa trị.
- Sự xen phủ trong HX là sự xen phủ s – p.
- Để đạt được trạng thái bền của khí hiếm gần nhất, các nguyên tố halogen nhận thêm 1 electron.
- Liên kết HX thuộc loại liên kết cộng hóa trị phân cực.
Phát biểu nào sau đây là đúng?
- Hydrohalic acid được dùng làm nguyên liệu để sản xuất hợp chất chống dính teflon là HF.
- Hydrohalic acid có tính khử mạnh nhất là HI.
- HCl và Cl2 đều làm quỳ tím ẩm chuyển sang màu đỏ (hồng) nên không phân biệt được.
- HX nào có năng lượng liên kết càng lớn thì độ bền liên kết càng cao ⇒ sắp xếp theo chiều tăng dần giá trị năng lượng liên kết: HI < HBr < HCl < HF.
Phát biểu nào sau đây là không đúng?
Cho F2 vào dung dịch NaCl; F2 oxi hóa nước có trong dung dịch:
2F2 + 2H2O → 4HF + O2.
Cho các phản ứng:
CaCO3(s) → CaO(s) + CO2(g) ![]() = +178,49 kJ
= +178,49 kJ
C (graphite, s) + O2(g) → CO2(g) ![]() = –393,51 kJ
= –393,51 kJ
Tính khối graphite cần dùng khi đốt cháy hoàn toàn đủ tạo lượng nhiệt cho quá trình nhiệt phân hoàn toàn 0,1 mol CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
Lượng nhiệt cần để thu được 0,1 mol CaO là: 0,1.178,49 = +17,849 kJ.
Lượng C (graphite, s) cần dùng là:
⇒ mC = 0,045.12 = 0,54 g.
Muốn khắc thủy tinh, người ta nhúng thủy tinh vào sáp nóng chảy và nhấc ra cho nguội, dùng vật nhọn tạo hình chữ, biểu tượng,… cần khắc. Sau đó, người ta sẽ chờ lớp sáp (nến) khô rồi nhỏ dung dịch HF vào thủy tinh và thu được sản phẩm được khắc theo mong muốn. Phương trình hóa học của phản ứng xảy ra khi khắc thủy tinh bằng dung dịch HF là
Phương trình hóa học:
4HF + SiO2 ⟶ SiF4 + 2H2O.
Cho 25 gam KMnO4 (có a% tạp chất) tác dụng với dung dịch HCl dư thu được khí chlorine. Để khí chlorine sinh ra phản ứng vừa đủ với dung dịch chứa 83 gam KI tạo I2, giá trị của a là
Cl2 + 2KI 2KCl + I2
nCl2 = 1/2.nKI = 0,25 mol
2KMnO4 + 16HCl 2KCl + 5Cl2 + 2MnCl2 + 8H2O
0,1 0,25
mKMnO4 = 15,8 g
Cho phản ứng:
Zn(s) + 2HCl(aq) ![]() ZnCl2(aq) + H2(g)
ZnCl2(aq) + H2(g)
Nếu tăng nồng độ dung dịch HCl thì số lần va chạm giữa các chất phản ứng sẽ:
Tăng nồng độ HCl lên thì số phân tử HCl sẽ tăng, do đó số lần va chạm hiệu quả giữa phân tử Zn và HCl sẽ tăng lên, do đó tốc độ phản ứng tăng.
Chất làm tăng tốc độ phản ứng hoá học, nhưng vẫn được bảo toàn về chất và lượng sau khi kết thúc phản ứng là
Chất làm tăng tốc độ phản ứng hoá học, nhưng vẫn được bảo toàn về chất và lượng sau khi kết thúc phản ứng là chất xúc tác.
Cho 2,13 gam hỗn hợp X gồm ba kim loại ở dạng bột tác dụng hoàn toàn với oxygen dư thu được hỗn hợp Y gồm các oxide có khối lượng 3,33 gam. Thể tích dung dịch HCl 2M vừa đủ để phản ứng hết với Y là:
Sơ đồ phản ứng:
Theo bảo toàn khối lượng ta có:
mO2 = moxide – mkim loại = 3,33 – 2,13 = 1,2 gam
⇒ nO2 = 0,0375 mol
⇒ nO = 2.nO2 = 0,075 mol
Từ sơ đồ ta thấy: nO (oxide) = nO (H2O)
⇒ nH2O = 0,075 (mol)
⇒ nHCl = 2nH2O = 0,15 mol
⇒ Vdd = 0,15:2 = 0,075 (lít) = 75 (ml)
Rót 3 mL dung dịch HCl 1 M vào 2 mL dung dịch NaOH 1 M, cho quỳ tím vào dung dịch sau phản ứng, mẩu quỳ tím sẽ:
nHCl = 0,003 mol, nNaOH = 0,002 (mol)
Phương trình phản ứng:
HCl + NaOH → NaCl + H2O
mol: 0,002 ← 0,002
⇒ Sau phản ứng HCl dư ⇒ mẩu quỳ tím sẽ hóa màu đỏ.
Hệ số nhiệt độ γ =
Cho sơ đồ phản ứng hoá học sau: NH3 + CuO → Cu + N2 + H2O. Nếu dùng 4,958 lít NH3 (đkc) khử hết CuO thì thu được m gam Cu. Vậy m là: (Cho H = 100%; Cu = 64)
nNH3 = 0,2 (mol)
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố:
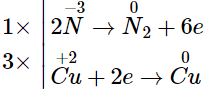
Phản ứng hoá học được cân bằng: 2NH3 + 3CuO 3Cu + 2N2↑ + 3H2O
Từ phương trình phản ứng ta có:
nCu = 1,5nNH3 = 0,3 (mol)
⇒ m = 0,3.64 = 19,2 (g).
Từ hai tấn muối ăn có chứa 5% tạp chất, người ta điều chế được 2500 lít dung dịch HCl 37% (d = 1,19 g/ml) bằng cách cho lượng muối ăn trên tác dụng với H2SO4 đậm đặc và đun nóng. Hiệu suất của quá trình điều chế là:
Lượng NaCl nguyên chất:
mNaCl nguyên chất = 2000.95% = 1900 kg
Lượng HCl thu được theo lí thuyết :
2NaCl + H2SO4 → Na2SO4 + 2HCl
m: 58,5 36,5
m: 1900 x
⇒ x = 1185,47 kg
Lượng HCl thu được theo thực tế:
mHCl tt = 2500.1,19.37% = 1100,75 kg
Hiệu suất của quá trình điều chế:
Chloramine B (C6H5ClNNaO2S) là chất thường được sử dụng để sát khuẩn trên các bề mặt, vật dụng hoặc dùng để khử trùng, sát khuẩn, xử lí nước sinh hoạt. Ở nồng độ cao, chloramine B có tác dụng diệt nấm mốc, vi khuẩn, virus gây bệnh cho người. Chloramine B có dạng viên nén (mỗi viên có khối lượng 0,3 – 2,0 gam) và dạng bột. Chloramine B 25% (250 mg chlorine hoạt tính trong một viên nén như hình bên) được dùng phổ biến, vì tiện dụng khi pha chế và bảo quản. Nồng độ chloramine B khi hòa tan vào nước đạt 0,001% có tác dụng sát khuẩn dùng trong xử lí nước sinh hoạt. Cần dùng bao nhiêu viên nén chloramine B 25% (loại viên 1 gam) để xử lí bình chứa 200 lít nước?
200 lít nước ⇔ 200000 g nước; 250 mg = 0,25 g.
Đặt x là số viên nén chloramine B 25% (loại viên 1 gam).
⇒ mchất tan = 0,25x (gam)
Áp dụng công thức tính nồng độ phần trăm:
⇔ x = 8
Vậy cần dùng 8 viên nén chloramine B 25% (loại viên 1 gam) để xử lí bình chứa 200 lít nước.
Dung dịch muối nào sau đây tác dụng với dung dịch AgNO3 tạo kết tủa màu trắng?
NaF + AgNO3 không phản ứng
NaCl + AgNO3 AgCl + NaNO3
( trắng)
NaBr + AgNO3 AgBr + NaNO3
( vàng nhạt)
NaI+ AgNO3 AgI + NaNO3
( vàng)
Người ta thường sử dụng nhiệt của phản ứng đốt than đá để nung vôi. Biện pháp kĩ thuật nào sau đây không được sử dụng để làm tăng tốc độ phản ứng nung vôi?
CaCO3(s) ![]() CaO(s) + CO2 (s) △H > 0
CaO(s) + CO2 (s) △H > 0
- Đập nhỏ đá vôi giúp đá vôi có diện tích tiếp xúc lớn hơn, dễ nhiệt phân hơn tăng tốc độ phản ứng.
- Tăng nhiệt độ giúp phản ứng xảy ra nhanh hơn tăng tốc độ phản ứng.
- CO2 là sản phẩm tạo thành, do vậy tăng nồng độ CO2 dẫn đến không làm tăng được tốc độ phản ứng.
- Thổi không khí nén vào bình giúp tăng áp suất và nhiệt độ tăng tốc độ phản ứng.
Hydrogen peroxide phân hủy theo phản ứng sau:
2H2O2 → 2H2O + O2
Tại thời điểm ban đầu, thể tích khí oxygen là 0 cm3, sau thời gian 15 phút thể tích khí oxygen là 16 cm3. Tốc độ trung bình của phản ứng trong 15 phút đầu tiên là
Tốc độ trung bình của phản ứng trong 15 phút đầu tiên là:
Trong các phản ứng dưới đây, phản ứng nào chứng tỏ chlorine vừa là chất oxi hóa, vừa là chất khử?
Chlorine vừa là chất oxi hóa vừa là chất khử khi trong phân tử vừa có nguyên tử Cl nhường elctron và vừa có nguyên tử nhận electron.
Phản ứng thõa mãn:
Xét phản ứng điều chế H2 trong phòng thí nghiệm:
Zn + 2HCl → ZnCl2 + H2.
Chất đóng vai trò chất khử trong phản ứng là
Trong phản ứng xảy ra các quá trình:
Chất khử là chất nhường electron ⇒ Zn là chất khử.
Trong nhóm halogen, từ fluorine đến iodine tính phi kim giảm dần do
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính phi kim giảm dần. Tuy điện tích hạt nhân tăng, nhưng bán kính nguyên tử tăng nhanh và chiếm ưu thế hơn nên lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm dẫn đến khả năng nhận electron giảm nên tính phi kim giảm.
Trong nhóm halogen, từ fluorine đến iodine tính phi kim giảm dần.
Khi tham gia các phản ứng đốt cháy nhiên liệu, oxygen đóng vai trò là
Các phản ứng đốt cháy nhiên liệu oxygen dạng O2 tạo thành H2O và CO2.
Số oxi hóa giảm từ 0 xuống -2 ⇒ Oxygen đóng vai trò là chất oxi hóa
Nguyên tử chlorine không có khả năng thể hiện số oxi hóa nào sau đây?
Chlorine có thể có các số oxi hóa: –1, 0, +1, +3, +5, +7.
Cho các phương trình nhiệt hóa học dưới đây:
(1) 2ClO2(g) + O3(g) → Cl2O7(g); ΔH1 = –75,7 kJ/mol.
(2) C(s) + O2(g) → CO2(g); ΔH2 = –393,5 kJ/mol.
(3) N2(g) + 3H2(g) → 2NH3(g); ΔH3 = –46,2 kJ/mol.
(4) O2(g) → 2O(g); ΔH4 = 498,3 kJ/mol.
Số quá trình tỏa nhiệt là
Các quá trình tỏa nhiệt có ΔH < 0, các quá trình thu nhiệt có ΔH > 0.
⇒ Các quá trình tỏa nhiệt là: (1), (2), (3).
Ion halide được sắp xếp theo chiều giảm dần tính khử:
Ion halide được sắp xếp theo chiều giảm dần tính khử: I-, Br-, Cl-, F-.
Cho 78 ml dung dịch AgNO3 10% (d = 1,09) vào một dung dịch có chứa 3,88 gam hỗn hợp KBr và KI. Lọc kết tủa, nước lọc có thể phản ứng vừa đủ với 13,3 ml dung dịch HCl 1,5M. Vậy thành phần phần trăm về khối lượng từng muối là:
Số mol các chất:
nHCl = 0,01995 mol
Gọi a, b là số mol của KBr và KI trong hỗn hợp.
KBr + AgNO3 AgBr
+ KNO3
a a
KI + AgNO3 AgI
+ KNO3
b b
AgNO3 + HCl AgCl
+ HNO3
0,01995 0,01995
Ta có hệ:
%mKI = 100% - 72,38% = 27,62%
Cho 27 gam hỗn hợp gồm chlorine và bromine tỉ lệ mol lần lượt là 5 : 2 vào dung dịch chứa 72 g NaI, phản ứng xong cô cạn dung dịch thu được m g chất rắn, giá trị m là
nNaI = 0,48 (mol)
Gọi số mol của chlorine và bromine lần lượt là x và y, ta có hệ phương trình:
Phương trình phản ứng:
Cl2 + 2NaI → 2NaCl + I2
Mol: 0,2 → 0,4 → 0,4
Số mol NaI còn lại là: 0,48 – 0,4 = 0,08 mol
Br2 + 2NaI → 2NaBr + I2
Tỉ lệ: 1 2
Mol: 0,08 0,08
Vì nên Br2 dư
⇒ nNaBr = 0,08 (mol)
⇒ m = mmuối = mNaCl + mNaBr
= 0,4.58,5 + 0,08.103
= 31,64 gam
Cho các phát biểu sau:
(a) Iodine là nguyên tố đa lượng cần thiết cho dinh dưỡng của con người.
(b) Từ fluorine đến iodine màu sắc halogen đậm dần.
(c) Nhiệt độ sôi của các hydrogen halide tăng dần từ HF đến HI.
(d) Hydrofluoric acid (HF) là acid mạnh.
Số phát biểu sai là
(a) Sai, vì iodine là nguyên tố vi lượng cần thiết cho dinh dưỡng của con người.
(b) Đúng.
(c) Đúng.
(d) Sai. HF là một acid yếu.
Cho halogen X2 tác dụng hết với potassium thì thu được 1,49 gam muối potassium halide. Cũng lượng X2 đó nếu cho tác dụng hết với aluminium thì thu được 0,89 gam muối aluminium halide. Nguyên tố halogen X là
Gọi số mol X2 là a mol.
X2 + 2K → 2KX
mol: a → a
3X2 + 2Al → 2AlX3
mol: a → 2/3a
Ta có hệ phương trình:
⇒ X = 35,5 (Cl)
Vậy X là chlorine.
Xét phản ứng hóa học đơn giản giữa hai chất A và B theo phương trình: A + B → C. Từ thông tin đã cho, xác định giá trị lần lượt của x và y trong bảng sau:
| Thực nghiệm | Nồng độ chất A (M) | Nồng độ chất B (M) | Tốc độ phản ứng (M/s) |
| 1 | 0,2 | 0,05 | 0,24 |
| 2 | x | 0,03 | 0,2 |
| 3 | 0,4 | y | 0,8 |
Biểu thức tốc độ phản ứng: v = k.CA.CB.
Theo kết quả thực nghiệm 1:
Từ thực nghiệm 2, tính được nồng độ chất A, từ thực nghiệm 3, tính được nồng độ chất B:
Chất bền hơn về mặt năng lượng so với các đơn chất bền tạo ra nó khi
- của đơn chất bền nhất = 0
- < 0, chất bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó.
- > 0, chất kém bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó.
Cho 2,24 gam hỗn hợp gồm: CaCO3 và Mg vào một lượng dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn thấy thoát ra 0,7437 lít hỗn hợp khí ở đkc. Xác định phần trăm khối lượng của CaCO3 trong hỗn hợp ban đầu.
nkhí = 0,03 mol
Gọi số mol CaCO3 là x (mol); số mol Mg là y (mol).
Phương trình hoá học:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O (1)
x → x mol
Mg + 2HCl → MgCl2 + H2 (2)
y → y mol
Theo bài ra, ta có hệ phương trình:
Đồ thị biểu diễn đường cong động học của phản ứng O2(g) + 2H2(g) → 2H2O(g) như sau:
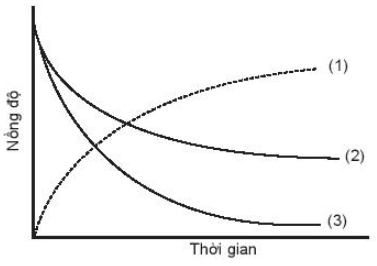
Đường cong nào của hydrogen?
Đường cong (1) là của nước do nồng độ tăng dần theo thời gian.
Trong hai đường cong (2) và (3) đường cong (3) là của hydrogen do nồng độ giảm theo thời gian và dựa vào tỉ lệ phản ứng thấy nồng độ hydrogen giảm nhiều hơn so với nồng độ oxygen.
Giá trị nhiệt độ và áp suất được chọn ở điều kiện chuẩn là:
Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và ở nhiệt độ không đổi, thường chọn nhiệt độ 25oC (hay 298 K).
Trong phản ứng tạo thành calcium chloride từ đơn chất: Ca + Cl2 → CaCl2. Kết luận nào sau đây đúng?
Trong phản ứng xảy ra các quá trình:
⇒ Mỗi nguyên tử Ca nhường 2 electron và mỗi nguyên phân tử chlorine nhận 2 electron.
Đơn chất halogen ở thể khí, màu vàng lục là
Đơn chất halogen ở thể khí, màu vàng lục là chlorine.
Số oxi hoá của nitrogen trong đơn chất là
Số oxi hóa của nguyên tử nguyên tố trong đơn chất bằng 0.
Hydrogen halide nào sau đây được dùng để tẩy cặn trong các thiết bị trao đổi nhiệt; chất xúc tác trong các nhà máy lọc dầu, công nghệ làm giàu uranium, sản xuất dược phẩm, …
Hydrogen fluoride được dùng để tẩy cặn trong các thiết bị trao đổi nhiệt; chất xúc tác trong các nhà máy lọc dầu, công nghệ làm giàu uranium, sản xuất dược phẩm…
Các enzyme là chất xúc tác, có chức năng:
Chất xúc tác làm tăng tốc độ của phản ứng hóa học (cụ thể là làm giảm năng lượng hoạt hóa của phản ứng) nhưng vẫn bảo toàn về chất và lượng khi phản ứng kết thúc.
