Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 ![]() 2HCl
2HCl
Biểu thức tốc độ trung bình của phản ứng là:
H2 + Cl2 2HCl
Biểu thức tốc độ trung bình của phản ứng là:
Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 ![]() 2HCl
2HCl
Biểu thức tốc độ trung bình của phản ứng là:
H2 + Cl2 2HCl
Biểu thức tốc độ trung bình của phản ứng là:
Tốc độ trung bình của phản ứng là
Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
Quá trình hoà tan calcium chloride trong nước:
CaCl2 (s) → Ca2+ (aq) + 2Cl- (aq)
| Chất | CaCl2 | Ca2+ | Cl– |
| –795,0 | –542,83 | –167,16 |
Tính biến thiên enthalpy của quá trình.
Enthalpy của quá trình:
=
(Ca2+) +
(Cl–) –
(CaCl2)
= –542,83 – 167,16 – (−795,00)
= 85,01 (kJ)
Cho quá trình sau: ![]() .
.
Đây là quá trình
Quá trình: có nguyên tử S nhận electron.
Vậy đây là quá trình khử.
Cho phản ứng: 2X(g) + Y(g) → Z(g) + T(g)
Nếu áp suất của hệ tăng 3 lần thì tốc độ phản ứng tăng hay giảm bao nhiêu lần?
Vban đầu = k.[X]2.[Y] = kx2y ( với x, y là nồng độ của X, Y)
Khi áp suất của hệ tăng 3 lần thì nồng độ các chất cũng tăng gấp 3 lần.
⇒ Vsau = k.[3X]2.[3Y] = k(3x)2.(3y) = 27kx2y
Vậy tốc độ phản ứng tăng lên 27 lần.
Phản ứng nào sau đây không có sự thay đổi số oxi hoá của nguyên tố Mn?
Phản ứng không có sự thay đổi số oxi hóa của Mn là:
Cho phương trình nhiệt hoá học của phản ứng:
2FeS(s) + 7/2O2(g) → Fe2O3(s) + 2SO2(g) ![]() = –1219,4 kJ.
= –1219,4 kJ.
Phản ứng trên là phản ứng
Phản ứng có = –1219,4 kJ < 0
⇒ Phản ứng là phản ứng tỏa nhiệt.
Liên kết trong phân tử nào sau đây có độ phân cực lớn nhất?
Độ âm điện giảm dần từ F đến I làm cho sự chênh lệch độ âm điện giữa H và halogen giảm dần ⇒ Độ phân cực H – X giảm dần từ HF đến HI.
Sục khí chlorine dư qua dung dịch NaBr, NaI. Kết thúc thí nghiệm, cô cạn dung dịch sau phản ứng thu được 23,40 gam muối khan. Biết các phản ứng xảy ra hoàn toàn. Thể tích khí chlorine (đkc) đã tham gia phản ứng với NaBr và NaI là:
Phương trình phản ứng
2NaBr + Cl2 → 2NaCl + Br2
2NaI + Cl2 → 2NaCl + I2
Ta có: nNaCl = 0,4 mol
⇒ nCl2 = = 0,2 mol
⇒ V = 4,958 (L).
Nguyên tố halogen dùng làm gia vị, cần thiết cho tuyến giáp và phòng ngừa khuyết tật trí tuệ là:
Iodine dùng làm gia vị, cần thiết cho tuyến giáp và phòng ngừa khuyết tật trí tuệ.
Cho bảng số liệu biểu diễn sự phụ thuộc thời gian phản ứng vào nồng độ chất tham gia phản ứng:
| Thể tích dung dịch và nước | Thời gian phản ứng |
| 5 ml + 5 ml | t1 |
| 4 ml + 6 ml | t2 |
| 3 ml + 7 ml | t3 |
| 2 ml + 8 ml | t4 |
Phát biểu nào sau đây không đúng?
Khi tăng nồng độ thì tốc độ phản ứng tăng ⇒ Thời gian phản ứng giảm
⇒ Chiều sắp xếp theo chiều giảm dần thời gian phản ứng là t1 > t2 > t3 > t4.
Phát biểu nào sau đây không đúng?
Nhiên liệu cháy ở trên vùng cao chậm hơn khi cháy ở vùng thấp. Vì khí oxygen nặng hơn không khí nên càng lên cao nồng độ oxygen càng giảm làm sự cháy diễn ra chậm hơn.
Số oxi hoá của Al trong NaAlH4 là
Trong các hợp chất, số oxi hóa của Al là +3.
Phát biểu nào sau đây là đúng?
- Sản phẩm cuối cùng của phản ứng giữa Fe3O4(s) và HI(aq) vừa đủ là FeI2, I2 và H2O.
- Ở trạng thái lỏng, giữa các phân tử HF tạo được liên kết hydrogen mạnh.
- Không thể làm khô khí hydrogen chlorine bằng NaOH(s), do xảy ra phản ứng:
NaOH + HCl → NaCl + H2O
- Dung dịch hydrohalic acid có khả năng ăn mòn thủy tinh là HF.
Chia 22,0 gam hỗn hợp X gồm Mg, Na, Ca thành 2 phần bằng nhau:
- Phần 1 cho tác dụng hết với O2 thu được 15,8 gam hỗn hợp 3 oxide.
- Phần 2 tác dụng với dung dịch HCl dư thu được V lít khí H2 (đkc). Giá trị của V là
Phần 1 và phần 2 như nhau nên số mol electron cho và nhận là như nhau.
- Phần 1:
Bảo toàn khối lượng ta có:
mO = mOxide – mKL = 15,8 – 11 = 4,8 gam
⇒ nO = 4,8 : 16 = 0,3 mol
⇒ ne cho = ne nhận = 2nO = 0,3.2 = 0,6 mol
- Phần 2:
ne cho = ne nhận = 2nH2 ⇒ 2nH2 = 0,6 ⇒ nH2 = 0,3 mol
⇒ VH2 = 0,3.24,79 = 7,437 lít
Đơn chất halogen nào sau đây phản ứng mạnh với nước ngay ở nhiệt độ thường, giải phóng khí O2?
F2 phản ứng mạnh với nước ngay ở nhiệt độ thường, giải phóng khí O2:
2F2 + 2H2O 4HF + O2
Các halogen Cl2, Br2 và I2 phản ứng chậm với nước và mức độ phản ứng giảm dần từ Cl2 đến I2.
Không khí trong phòng thí nghiệm bị ô nhiễm bởi khí chlorine. Để khử độc, có thể xịt vào không khí dung dịch nào sau đây?
Để loại bỏ khí chlorine ô nhiễm trong phòng thí nghiệm, người ta có thể xịt dung dịch NH3 vào không khí:
2NH3 + 3Cl2 → 3N2 + 6HCl;
2NH3 + HCl → NH4Cl.
Cho các chất sau: CuO (1), Zn (2), Ag (3), Al(OH)3 (4), KMnO4 (5), PbS (6), MgCO3 (7), AgNO3 (8), MnO2 (9), FeS (10). Số chất không tác dụng với acid HCl là
Ag đứng sau (H) trong dãy hoạt động hóa học nên không phản ứng với HCl.
PbS là kết tủa không tan trong acid.
Enthalpy tạo thành chuẩn của một đơn chất bền
Enthalpy tạo thành chuẩn của một đơn chất bền bằng 0.
Tính số phản ứng chứng minh tính khử của các ion halide trong các phản ứng sau:
(1) BaCl2 + H2SO4 → BaSO4↓ + 2HCl
(2) 2NaCl ![]() 2Na + Cl2↑
2Na + Cl2↑
(3) 2HBr + H2SO4 → Br2 + SO2↑ + 2H2O
(4) HI + NaOH → NaI + H2O
Phản ứng (2) và (3) chứng minh tính khử của các ion halide.
- Với phản ứng (2): 2NaCl 2Na + Cl2↑
Số oxi hóa của Cl tăng từ -1 lên 0 sau phản ứng;
- Với phản ứng (3) 2HBr + H2SO4 → Br2 + SO2↑ + 2H2O
Số oxi hóa của Br tăng từ -1 lên 0 sau phản ứng.
Tốc độ phản ứng giữa KMnO4 và H2C2O4 có thể được xác định qua sự thay đổi màu của dung dịch do biến thiên nồng độ của ion MnO4–. Khi tiến hành phản ứng ở nhiệt độ không đổi 25oC, người ta thu được các số liệu sau:
| Thí nghiệm | CMnO4–; M | CH2C2O4; M | Tốc độ biến mất của MnO4–; M.s-1 |
| 1 | 1,08.10-2 | 1,98 | 5,4.10-5 |
| 2 | 1,08.10-2 | 3,97 | 1,1.10-4 |
| 3 | 2,17.10-2 | 1,98 | 2,1.10-4 |
Công thức tính tốc độ của phản ứng trên là
Ta có biểu thức:
Thay số liệu trong bảng vào biểu thức trên ta có:
Thí nghiệm 1: v1 = k.1,98a.(1,08.10−2)b = 5,4.10−5 (1)
Thí nghiệm 2: v2 = k.3,97a.(1,08.10−2)b = 1,1.10−4 (2)
Thí nghiệm 3: v3 = k.(1,98)a.(2,17.10−2)b = 2,1.10−4 (3)
Từ (1) và (2) suy ra a = 1
Từ (1) và (3) suy ra b = 2
⇒ Công thức tính tốc độ của phản ứng trên là
Phát biểu nào dưới đây không đúng trong phản ứng oxi hoá - khử?
Trong phản ứng oxi hóa - khử luôn xảy ra đồng thời quá trình oxi hóa và quá trình khử.
Hấp thụ V lít Cl2 ở đktc vào 250 ml dung dịch KOH 1M, sau phản ứng thu được dung dịch B. Cô cạn dung dịch B thu được 19,3 gam rắn khan. Giá trị của V là:
2KOH + Cl2 → KCl + KClO + H2O
Gọi số mol KOH phản ứng là x mol
⇒ Sau phản ứng có: 0,5x mol KCl; 0,5x mol KClO và (0,25 – x) mol KOH dư.
⇒ mrắn sau = 74,5.0,5x + 90,5.0,5x + 56.(0,25 – x) = 19,3g
⇒ x = 0,2 mol
⇒ nCl2 = 0,1 (mol)
⇒ VCl2 = 0,1.24,79 = 2,479 (l).
Thí nghiệm nghiên cứu tốc độ phản ứng giữa kẽm (zinc) với dung dịch hydrochloric acid của hai nhóm học sinh được mô tả bằng hình sau:
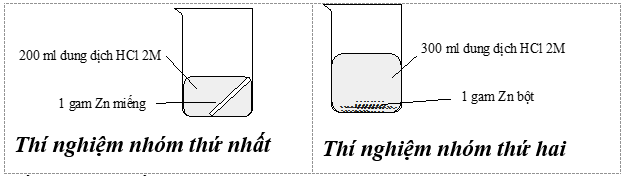
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do
Phản ứng diễn ra nhanh hơn khi sử dụng kẽm bột; do với cùng khối lượng kẽm diện tích bề mặt kẽm bột lớn hơn so với kẽm miếng.
Cho m gam Mg tác dụng vừa đủ với dung dịch H2SO4 đặc đến khi phản ứng xảy ra hoàn toàn thu được dung dịch X và 2,479 lít khí SO2 (sản phẩm khử duy nhất S+6, ở đkc). Giá trị của m là
nSO2 = 0,1 (mol)
Quá trình nhường electron:
Quá trình nhận electron:
Áp dụng bảo toàn electron:
2nMg = 2nSO2 ⇒ nMg = nSO2 = 0,1 mol
⇒ mMg = 0,1.24 = 2,4 gam
Cho phản ứng: NaX(khan) + H2SO4 (đậm đặc) ![]() NaHSO4 + HX(khí).
NaHSO4 + HX(khí).
Các hydrogen halide có thể điều chế theo phản ứng trên là
Hydrogen halide có thể điều chế theo phản ứng trên là HF và HCl.
Không thể là HBr và HI vì khí HBr và HI sinh ra phản ứng được với H2SO4 đặc nóng.
Cho FeS tác dụng với dung dịch HCl, khí bay ra là:
Cho FeS tác dụng với dung dịch HCl, khí bay ra là: H2S.
FeS + 2HCl → FeCl2+ H2S↑
Cho các phản ứng hoá học sau:
(a) Fe3O4(s) + 4CO(g) → 3Fe(s) + 4CO2(g)
(b) 2NO2(g) → N2O4(g)
(c) H2(g) + Cl2(g) → 2HCl(g)
(d) CaO(s) + SiO2(s) → CaSiO3(s)
(e) CaO(s) + CO2(g) → CaCO3(s)
Số phản ứng có tốc độ phản ứng thay đổi khi áp suất thay đổi là
Việc thay đổi áp suất chỉ làm ảnh hưởng đến tốc độ phản ứng khi có chất khí tham gia.
⇒ Tốc độ các phản ứng (a), (b), (c), (e) thay đổi khi áp suất thay đổi.
Cho dung dịch AgNO3 vào 4 ống nghiệm chứa NaF, NaCl, NaBr, NaI.
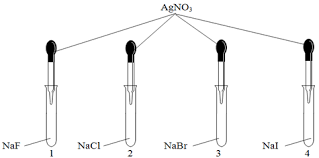
Hiện tượng xảy ra trong các ống 1, 2, 3, 4 là:
Hiện tượng xảy ra trong các ống 1, 2, 3, 4 là: Không có hiện tượng, có kết tủa trắng, có kết tủa vàng, có kết tủa vàng đậm.
Phương trình phản ứng xảy ra:
NaF(aq) + AgNO3(aq) → không xảy ra phản ứng.
NaCl(aq) + AgNO3(aq) → AgCl(s)↓ (màu trắng) + NaNO3(aq).
NaBr(aq) + AgNO3(aq) → AgBr(s)↓ (màu vàng) + NaNO3(aq).
NaI(aq) + AgNO3(aq) → AgI(s)↓ (màu vàng đậm) + NaNO3(aq).
Một hỗn hợp X gồm ba muối NaF, NaCl, NaBr nặng 4,82 gam. Hòa tan hoàn toàn X trong nước được dung dịch A. Sục khí chlorine dư vào dung dịch A rồi cô cạn hoàn toàn dung dịch sau phản ứng thu được 3,93 gam muối khan. Lấy một nửa lượng muối khan này hòa tan vào nước rồi cho phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa Z. Tính phần trăm khối lượng mỗi muối trong hỗn hợp ban đầu.
Đặt nNaF = x; nNaCl = y; nNaBr = z
Khi sục chlorine vào dung dịch A:
Cl2 + 2NaBr 2NaCl + Cl2
Vì AgF tan trong nước nên kết tủa Z chỉ gồm AgCl.
Ta có hệ phương trình:
%mNaBr = 42,74%
Cho các phát biểu sau:
(1) Phản ứng tỏa nhiệt tự xảy ra ở điều kiện thường, phản ứng thu nhiệt không tự xảy ra ở điều kiện thường.
(2) Đốt khí gas hóa lỏng đun nấu trong gia đình là phản ứng tỏa nhiệt.
(3) Củi khô thanh nhỏ cháy nhanh hơn củi khô thanh to là do yếu tố diện tích tiếp xúc.
(4) Mùa hè ta thấy thức ăn nhanh ôi thiu hơn mùa đông là do yếu tố nồng độ oxygen trong không khí.
(5) Phản ứng thu nhiệt có ∆H < 0 và dễ xảy ra.
(6) Những chất dễ cháy, nổ cần tuân thủ nghiêm các nguyên tắc phòng cháy để tránh thiệt hại về người, của cải, vật chất.
Các phát biểu đúng là
Các phát biểu đúng là (2), (3), (6).
(1) Sai vì một số phản ứng tỏa nhiệt cần phải khơi mào.
(4) Sai vì mùa hè ta thấy thức ăn nhanh ôi thiu hơn mùa đông là do yếu tố nhiệt độ.
(5) Phản ứng thu nhiệt có ∆H > 0 và khó xảy ra.
Cho phản ứng tổng quát sau:
X2(g) + 2KBr(aq) → 2KX(aq) + Br2(aq)
X có thể là chất nào sau đây?
Trong dung dịch, các halogen có tính oxi hóa mạnh hơn (trừ fluorine) sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn.
Cl2(g) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq)
Đốt cháy hoàn toàn m gam hỗn hợp gồm Cu, Fe cần vừa đủ 4,958 lít khí Cl2 (đkc), thu được 23 gam hỗn hợp muối. Giá trị của m là
Áp dụng bảo toàn khối lượng:
mFe + mCu + mCl2 = mmuối
m + 14,2 = 23
m = 8,8 (gam)
Phương trình hoá học nào sau đây là sai?
Phương trình hóa học viết sai là:
Sửa lại: 2Fe + 3Cl2 → 2FeCl3.
Hãy cho biết việc sử dụng chất xúc tác đã được áp dụng cho quá trình nào sau đây?
Quá trình sử dụng chất xúc tác giúp làm tăng tốc độ phản ứng là: phản ứng oxi hóa SO2 thành SO3 diễn ra nhanh hơn khi có mặt V2O5.
Cho phương trình phản ứng sau: N2(g) + O2(g) → 2NO(g)
Dựa vào năng lượng liên kết sai: liên kết N≡N với Eb = 945 kJ/mol, liên kết O=O với Eb = 494 kJ/mol, liên kết N=O với Eb = 607 kJ/mol. Nhận định nào sau đây là đúng?
= [Eb(N≡N).1 + Eb(O=O).1] − Eb(N=O).2
= [945.1 + 494.1] – 607.2
= 225 (kJ)
= 225 kJ > 0 ⇒ Phản ứng thu nhiệt.
⇒ Để phản ứng xảy ra, cần cung cấp lượng nhiệt lớn 225 kJ/mol.
Nitrogen chỉ phản ứng với oxygen khi ở nhiệt độ cao hoặc có tia lửa điện để tạo thành NO.
Một phản ứng có hệ số nhiệt độ Van’t Hoff là 2. Hỏi tốc độ của phản ứng đó tăng lên bao nhiêu lần khi nâng nhiệt độ lên từ 20oC đến 60oC?
Áp dụng mối liên hệ của hệ số Van't Hoff với tốc độ và nhiệt độ:
Trong đó γ = 2, T2 = 60oC, T1 = 20oC
⇒ Với phản ứng có γ = 2, nếu nhiệt độ tăng từ 20oC lên 60oc thì tốc độ phản ứng tăng 16 lần.
Ta có:
Chlorine đóng vai trò chất oxi hóa.
Nguyên tố halogen nào sau đây là nguyên tố phóng xạ?
Trong nhóm halogen có hai nguyên tố phóng xạ là astatine và tennessine.
Phát biểu nào sau đây là không đúng khi nói về một số ứng dụng của đơn chất chlorine?
Khí chlorine không được sử dụng để trừ sâu trong nông nghiệp.
