Gọi CTPT chung của aldehyde X và Y no, mạch hở, 2 chức là CaH2a-2O2
 Đốt cháy hỗn hợp A thu được: nCO2 – nH2O = nA
Đốt cháy hỗn hợp A thu được: nCO2 – nH2O = nA
nCa(OH)2 = 0,125 mol; nCaCO3 = 0,09 mol
TH1: Chỉ thu được 1 kết tủa CaCO3
 nCO2 = nCaCO3 = 0,09 mol
nCO2 = nCaCO3 = 0,09 mol
mbình tăng = mCO2 + mH2O = 9,29  nH2O = 0,296 > nCO2
nH2O = 0,296 > nCO2  loại
loại
TH2: Thu được 2 muối CaCO3 và Ca(HCO3)2
Bảo toàn Ca: nCa(HCO3)2 = nCa(OH)2 – nCaCO3 = 0,125 – 0,09 = 0,035 mol
Bảo toàn C: nCO2 = 2.nCa(HCO3)2 + nCaCO3 = 2.0,035 + 0,09 = 0,16 mol
mbình tăng = mCO2 + mH2O = 9,29  mH2O = 2,25 gam
mH2O = 2,25 gam  nH2O = 0,125 mol
nH2O = 0,125 mol
 nA = nCO2 – nH2O = 0,16 – 0,125 = 0,035 mol
nA = nCO2 – nH2O = 0,16 – 0,125 = 0,035 mol
 số C trung bình =
số C trung bình =  = 4,57
= 4,57
 X và Y lần lượt là C4H6O2 và C5H8O2.
X và Y lần lượt là C4H6O2 và C5H8O2.








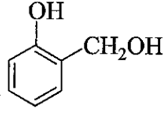 thuộc loại monophenol nên tác dụng với NaOH theo tỉ lệ mol 1 : 1.
thuộc loại monophenol nên tác dụng với NaOH theo tỉ lệ mol 1 : 1.