Tính thể tích dung dịch Br2 16% (d = 1,25 gam/ml) đủ để tác dụng với 9,4 gam phenol.
nphenol = 0,1 mol
Phương trình hóa học:
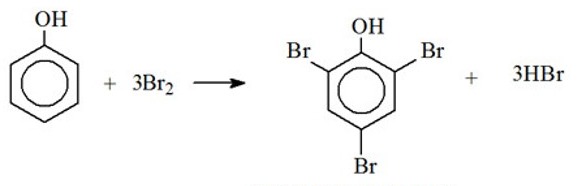
Từ phương trình ta có:
nBr2 = 3nC6H5OH = 0,3 mol
mBr2 = 48 gam
Tính thể tích dung dịch Br2 16% (d = 1,25 gam/ml) đủ để tác dụng với 9,4 gam phenol.
nphenol = 0,1 mol
Phương trình hóa học:

Từ phương trình ta có:
nBr2 = 3nC6H5OH = 0,3 mol
mBr2 = 48 gam
Tổng số đồng phân (kể cả đồng phân cis – trans) của C3H5Br là
CH2=CH–CH2Br; CH2=CBr–CH3; CHBr=CH–CH3 (-cis, -trans).
Một chai rượu gạo có thể tích 700 mL và có độ rượu là 30o. Số mL ethanol nguyên chất (khan) có trong chai rượu đó là
Độ rượu 30o
100 mL rượu có 30 mL C2H5OH.
700 mL rượu có x mL C2H5OH
Số mL ethanol nguyên chất (khan) có trong chai rượu đó là:
Acetone được điều chế bằng cách oxi hoá cumene nhờ oxygen, sau đó thuỷ phân trong dung dịch H2SO4 loãng. Để thu được 87 gam acetone thì lượng cumene cần dùng (giả sử hiệu suất quá trình điều chế đạt 80%) là
Phương trình hoá học:
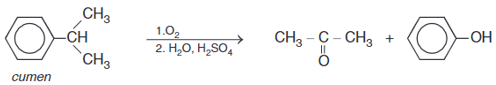
nCH3COCH3 = 87 : 58 = 1,5 mol
⇒ ncumene= 1,5 (mol).
⇒ mcumene đã dùng =
Picric acid (2,4,6-trinitrophenol) trước đây được sử dụng làm thuốc nổ. Để tổng hợp picric acid, người ta cho 37,6 g phenol phản ứng với hỗn hợp HNO3 đặc/ H2SO4 đặc, dư. Tính khối lượng picric acid thu được, biết hiệu suất phản ứng là 65%.
Phương trình phản ứng
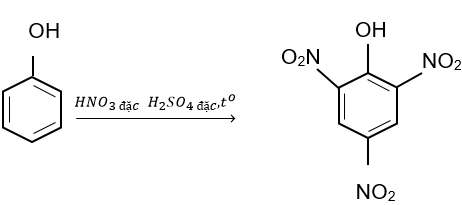
Số mol phenol: nphenol = 37,6 : 94 = 0,4 (mol)
Số mol picric acid tạo thành:
Khối lượng picric acid thu được:
mpicricacid = 0,26.229 = 59,54 (g).
Hợp chất chứa nhóm C=O liên kết với nguyên tử carbon hoặc nguyên tử hydrogen được gọi là
Hợp chất chứa nhóm C=O liên kết với nguyên tử carbon hoặc nguyên tử hydrogen được gọi là hợp chất carbonyl.
Sản phẩm chính tạo thành khi cho 2-bromobutane tác dụng với dung dịch KOH/alcohol, đun nóng là:
Quy tắc Zaitsev: Trong phản ứng tách hydrogen halide (HX) ra khỏi dẫn xuất halogen, nguyên tử halogen (X) được ưu tiên tách ra cùng với nguyên tử hydrogen (H) ở nguyên tử carbon bên cạnh có bậc cao hơn, tạo ra sản phẩm chính.
CH3CHBrCH2CH3 CH3CH=CHCH3
but-2-ene
Alcohol bị oxi hoá bởi CuO, t° tạo thành aldehyde là
- Alcohol bậc I bị oxi hoá bởi CuO, t° tạo thành aldehyde.
- Alcohol bậc II bị oxi hoá bởi CuO, t° tạo thành ketone.
- Alcohol bậc III không bị oxi hóa bởi CuO, t°.
⇒ CH3CH2OH bị oxi hoá bởi CuO, t° tạo thành aldehyde.
Thực hiện phản ứng khử hợp chất X bằng hydrogen có xúc tác thích hợp, thu được 2-methylpropan-1-ol (isobutyl alcohol). Công thức của X là
Hợp chất aldehyde bị khử bởi hydrogen ở vị trí có các liên kết π.
Đáp án đúng là aldehyde có khung carbon giống 2-methylpropan-1-ol.
Trong công nghiệp chế biến đường từ mía, nho, củ cải đường sẽ tạo ra sản phẩm phụ, gọi là rỉ đường hay rỉ mật, sử dụng rỉ đường để lên men tạo ra ethanol trong điều kiện thích hợp, hiệu suất cả quá trình là 90%. Tính khối lượng ethanol thu được từ 1 tấn rỉ đường mía theo 2 phương trình:
C12H22O11 + H2O → C6H12O6 (glucose) + C6H12O6 (fructose)
C6H12O6 (glucose/ fructose) → 2C2H5OH (ethanol) + 2CO2
mC12H22O11 = 106 (g) ⇒ nC12H22O11 = 2,924 mol
C12H22O11 + H2O → C6H12O6 (glucose) + C6H12O6 (fructose)
mol: 2,924 → 2,924
C6H12O6 (glucose/ fructose) → 2C2H5OH (ethanol) + 2CO2
mol: 2.2,924 → 2.2.2,924
m = 2,924.2.2.46 = 538,016 (kg)
⇒ Khối lượng ethanol thu được với hiệu suất 90%:
mC2H5OH = 2.2.2,924.46.90% = 484,214 (kg)
Formalin (còn gọi là formon) được dùng để ngâm xác động, thực vật, thuộc da, tẩy uế, diệt trùng, ... Formalin là
Formalin (còn gọi là formon) được dùng để ngâm xác động, thực vật, thuộc da, tẩy uế, diệt trùng, ... Formalin là dung dịch trong nước, chứa khoảng 37% – 40% formaldehyde.
Methanol có công thức là
Methanol có công thức là CH3OH.
Cho sơ đồ chuyển hóa sau:
![]()
Các chất X, Y, Z lần lượt là
C6H6 + Br2 C6H5Br + HBr
C6H5Br + 2NaOH C6H5ONa + H2O + NaBr
C6H5ONa + HCl → C6H5OH + NaCl
Hỗn hợp X gồm hai alcohol đều có công thức dạng RCH2OH (R là gốc hydrocarbon mạch hở). Dẫn m gam X qua ống sứ chứa CuO dư, đun nóng thu được hỗn hợp khí và hơi Y, đồng thời khối lượng ống sứ giảm 4,48 gam. Cho toàn bộ Y vào lượng dư dung dịch AgNO3 trong NH3, đun nóng thu được 86,4 gam Ag. Nếu đun nóng m gam X với H2SO4 đặc ở 140oC, thu được 10,39 gam hỗn hợp Y gồm các ether. Biết hiệu suất phản ứng của các alcohol có khối lượng phân tử tăng dần lần lượt là 75% và 80%. Công thức của alcohol có khối lượng phân tử lớn hơn là
nAg = 0,8 (mol)
Khối lượng ống sứ giảm là khối lượng oxygen:
⇒ nRCHO = nO = 0,28 mol
Vì nAg > 2nRCHO nên aldehyde gồm HCHO (xmol) và ACHO (y mol).
Ta có hệ phương trình:
Vậy X gồm: CH3OH (0,12 mol) và ACH2OH (0,16 mol).
nCH3OH p/ứ = 0,12.75% = 0,09 mol
nACH2OH p/ứ = 0,16.80% = 0,128 mol
⇒ malcohol phản ứng = 0,09.32 + 0,128.(A + 31) = 10,39 + 0,109.18
⇒ A = 43 (C3H7)
Vậy alcohol còn lại là: C3H7CH2OH hay C4H9OH.
Đun nóng hỗn hợp gồm CH3OH và 0,2 mol C2H5OH với H2SO4 đặc ở 140oC, khối lượng ether thu được là
Trong phản ứng ether hóa ta luôn có:
nH2O = .nalcohol =
.(0,1 + 0,2) = 0,15 mol
Bảo toàn khối lượng:
mether = malcohol – mH2O
= 0,1 .32 + 0,2 .46 – 0,15 .18
= 9,7 (gam)
Cho các dẫn xuất halogen sau:
(1) C2H5F; (2) C2H5Cl; (3) C2H5Br; (4) C2H5I.
Thứ tự tăng dần nhiệt độ sôi là
Tất cả đều là dẫn xuất halogen, phân tử khối càng lớn thì nhiệt độ sôi càng cao.
⇒ Thứ tự tăng dần nhiệt độ sôi là: (1) < (2) < (3) < (4).
Chất nào sau đây không tham gia phản ứng tráng bạc?
CH≡CH không tham gia phản ứng với thuốc thử Tollens tạo thành kim loại Ag nên không tham gia phản ứng tráng bạc.
Một loại giấm ăn có chứa hàm lượng 4,5% acetic acid về thể tích. Tính thể tích dung dịch NaOH 2M cần để trung hoà hết 5 L giấm trên, biết khối lượng riêng của acetic acid là D = 1,05 g/mL.
Thể tích acetic acid có trong 5 L giấm ăn:
VCH3COOH = 5.4,5% = 0,225 (L) = 225 (mL)
Khối lượng acetic acid tương ứng là:
mCH3COOH = 225.1,05 = 236,25 (g)
Phương trình phản ứng:
CH3COOH + NaOH → CH3COONa + H2O
Hai alcohol nào sau đây cùng bậc?
Methanol (CH3OH) và allyl alcohol (CH2=CH–CH2–OH) đều là alcohol bậc một.
Dẫn 6 gam hơi ethanol đi qua ống sứ chứa CuO dư, nung nóng. Hơi thoát ra được làm lạnh để ngưng tụ thu được chất lỏng X. Biết X phản ứng hết với lượng dư AgNO3/ NH3 được 16,2 gam bạc. Hiệu suất phản ứng oxi hoá ethanol là
nAg = 0,15 (mol)
Phương trình hóa học:
CH3CH2OH + CuO CH3CHO + Cu + H2O (1)
mol: 0,075 ← 0,075
CH3CHO + 2AgNO3 + 3NH3 + H2O CH3COONH4 + 2Ag + 2NH4NO3 (2)
mol: 0,075 ← 0,15
Hiệu suất của phản ứng là:
Hợp chất nào sau đây thuộc loại dẫn xuất halogen của hydrocarbon?
Dẫn xuất halogen của hydrocarbon là hợp chất thu được khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng một hay nhiều nguyên tử halogen.
⇒ Hợp chất thuộc loại dẫn xuất halogen của hydrocarbon là CH2BrCl.
Cho quỳ tím vào dung dịch acetic acid, quỳ tím
Acetic acid làm cho quỳ tìm chuyển sang màu đỏ.
Đốt cháy hoàn toàn một aldehyde X, thu được số mol CO2 bằng số mol H2O. Nếu cho X tác dụng với lượng dư AgNO3 trong dung dịch NH3, sinh ra số mol Ag gấp bốn lần số mol X đã phản ứng. Công thức của X là:
Theo bài ra ta có:
Đốt cháy hoàn toàn một aldehyde X thu được: nCO2 = nH2O
⇒ Aldehyde đơn chức, no mạch hở, đơn chức: CnH2nO.
X tráng bạc cho nAg = 4nX ⇒ X là HCHO.
Số đồng phân aldehyde có cùng công thức C5H10O, mạch hydrocarbon phân nhánh là
Các đồng phân aldehyde có cùng công thức C5H10O, mạch hydrocarbon phân nhánh là:
CH3CH(CH3)CH2CHO;
CH3CH2CH(CH3)CHO;
CH3C(CH3)2CHO.
Ở điều kiện thường, chất tồn tại ở thể rắn là
Ở điều kiện thường, phenol tồn tại ở thể rắn.
Cho các chất sau: Na, NaOH, CuO, CH3COOH, Cu(OH)2, nước bromine. Số chất tác dụng được với ethyl alcohol (trong những điều kiện thích hợp) là
2C2H5OH + 2Na → 2C2H5ONa + H2
CH3CH2OH + CuO CH3CHO + Cu + H2O
CH3CH2OH + CH3COOH CH3COOC2H5 + H2O
Khi cho ethanal phản ứng với Cu(OH)2 trong môi trường kiềm ở nhiệt độ thích hợp, hiện tượng nào sau đây sẽ xảy ra?
Trong môi trường kiềm, Cu(OH)2 oxi hóa hầu hết các aldehyde thành muối carboxylate và sinh ra kết tủa Cu2O có màu đỏ gạch.
Vị chua của giấm là do chứa
Vị chua của giấm là do chứa acetic acid
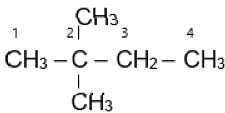
Tên gọi của dẫn xuất halogen có công thức cấu tạo CH3-CCl(CH3)-CH2-CH3 là:
Tên gọi của dẫn xuất halogen có công thức cấu tạo CH3-CCl(CH3)-CH2-CH3 là 2-chloro-2-methylbutane
Cho m gam hỗn hợp X gồm phenol và ethanol tác dụng với Na dư thu được 25,2 hỗn hợp muối. Cho m/10 gam lượng hỗn hợp X phản ứng vừa đủ với 10 ml dung dịch NaOH 1M. Số mol của ethanol và phenol là:
Phương trình phản ứng:
C6H5OH + Na C6H5ONa + 1/2H2
x x mol
C2H5OH + Na C2H5ONa + 1/2H2
y y mol
C6H5OH + NaOH C6H5ONa + H2O
0,01 0,01 mol
Ta có hệ phương trình:
Trộn 20 mL ethanol với 20 mL acetic acid, thêm 10 mL H2SO4 đặc rồi tiến hành phản ứng ester hóa. Sau một thời gian, thu được 17,6 g ester. Tính hiệu suất phản ứng ester, biết khối lượng riêng của ethanol và acetic acid lần lượt là 0,789 g/mL và 1,05 g/mL.
CH3COOH + CH3CH2OH ⇌ CH3COOCH2CH3 + H2O
Ta có: nC2H5OH < nCH3COOH ⇒ Hiệu suất tính theo số mol alcohol.
nester(lt) = nC2H5OH = 0,343 (mol).
Formic acid (HCOOH) có trong nọc kiến, nọc ong, sâu róm. Nếu không may bị ong đốt thì nên bôi vào vết ong đốt loại chất nào sau đây là tốt nhất?
Vôi có thể trung hòa formic acid (HCOOH) có trong nọc ong nên nếu không may bị ong đốt thì nên bôi vôi vào vết ong đốt.
Chất nào sau đây không phải là phenol?
Hợp chất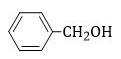 không phải là phenol mà là alcohol thơm.
không phải là phenol mà là alcohol thơm.
Dẫn xuất halogen bậc II có tên phù hợp là:
Cl–CH2–CH2–Cl: 1,2-dichloroethane
Bậc I.
CH3–CHl–CH3: 2-iodopropane.
Bậc II
CH3–CH(CH3)–CH2–Br: 1-bromo-2-methylpropane.
Bậc I.
FC(CH3)3: 2-fluoro-2-methylpropane
Bậc III
Hợp chất X no, mạch hở có phần trăm khối lượng C và H lần lượt bằng 66,67% và 11,11 %, còn lại là O. Trên phổ MS tìm thấy tín hiệu ứng với phân tử khối của X là 72. X không tác dụng với dung dịch AgNO3 trong NH3 nhưng có phản ứng tạo iodoform. X là:
Ta có %mO = 22,22%
Gọi công thức tổng quát của X là: CxHyOz
= 4 : 8 : 1
⇒ Công thức đơn giản nhất của X là C4H8O.
Gọi cống thức phân tử của X là (C4H8O)n
⇒ Mx = (4.12 + 8 + 16)n = 72n = 72 ⇒ n = 1.
Vậy công thức phân tử của X là C4H8O.
X không tác dụng được với dung dịch AgNO3 trong NH3 nên X là ketone.
Do X có phản ứng tạo iodoform nên phân tử của X có chứa nhóm CH3CO−.
Vậy công thức cấu tạo của X là
CH3COCH2CH3 (ethyl methyl ketone hay butanone).
Cặp dung dịch nào sau đây đều có thể hoà tan Cu(OH)2 ở nhiệt độ thường?
Aldehyde và ketone không có phản ứng với Cu(OH)2 ở nhiệt độ thường.
Phát biểu nào sau đây đúng khi nói về tính chất của phenol?
- Phenol là chất rắn, không màu; phenol độc, gây bỏng cho da. Phenol ít tan trong nước lạnh, tan vô hạn trong nước ở 66oC, tan tốt trong ethanol.
- Phenol có nhiệt độ nóng chảy, nhiệt độ sôi cao hơn các hydrocarbon thơm có khối lượng phân tử tương đương.
- Phenol thể hiện tính acid yếu. Dung dịch phenol không làm đổi màu quỳ tím.
Đốt cháy hoàn tòn 0,1 mol một carboxylic acid đơn chức, cần vừa đủ V lít O2 (ở đkc), thu được 0,3 mol CO2 và 0,2 mol H2O. Giá trị của V là
Gọi acid là RCOOH.
Ta có nacid = 0,1 mol ⇒ nO trong acid = 0,2 mol
Áp dụng ĐLBT nguyên tố O:
nO trong acid + 2.nO2 = 2.nCO2 + nH2O
⇒ V = 0,3. 24,79 = 7,437 lít
Hợp chất thuộc loại polyalcohol là
Alcohol có từ 2 nhóm oH trở lên gọi là alcohol đa chức hay polyalcohol, polyol.
⇒ Hợp chất thuộc loại polyalcohol là HOCH2CH2CH2OH.
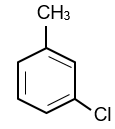
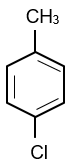
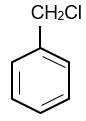
Hợp chất A là dẫn xuất monochloro của alkylbenzene. Phân tử khối của A bằng 126,5. Số công thức cấu tạo có thể có của A.
A là dẫn xuất monochloro của alkylbenzene nên công thức phân tử của A có dạng CnH2n−7Cl.
12n + 2n − 7 + 35,5 = 126,5 ⇒ n = 7
⇒ Công thức phân tử của A là C7H7Cl.
 |
 |
 |
 |
Vậy có 4 đồng phân
