Cho quá trình sau: ![]() .
.
Đây là quá trình
Quá trình: có nguyên tử Cu nhường electron.
Vậy đây là quá trình oxi hóa.
Cho quá trình sau: ![]() .
.
Đây là quá trình
Quá trình: có nguyên tử Cu nhường electron.
Vậy đây là quá trình oxi hóa.
Cho sơ đồ của phản ứng oxi hóa - khử sau: Mg + HNO3 → Mg(NO3)2 + NO + H2O.
Hòa tan hoàn toàn 7,2 gam magnesium vào dung dịch nitric acid loãng. Tính thể tích khí nitrogen monooxide (NO) tạo thành ở điều kiện chuẩn.
- Lập phương trình phản ứng:
Sự thay đổi số oxi hóa của các nguyên tử:
Thăng bằng electron:
Cân bằng phản ứng: 3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
- Tính thể tích khí NO:
nMg = 0,3 (mol)
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
mol: 0,3 → 0,2
⇒ VNO = 0,2.24,79 = 4,958 (lít)
Số oxi hóa âm thấp nhất của S trong các hợp chất là
Số oxi hóa âm thấp nhất của S trong các hợp chất là -2.
nH2 = 0,8 (mol)
Đốt cháy hoàn toàn 1 mol H2 thì nhiệt lượng tỏa ra là –285,84 kJ.
⇒ Đốt cháy 0,8 mol H2 thì nhiệt lượng tỏa ra là: (–285,84).0,8 = –228,672 kJ.
Điều kiện chuẩn là điều kiện ứng với áp suất (đối với chất khí), nồng độ (đối với chất tan trong dung dịch) và nhiệt độ nào sau đây?
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy hoàn toàn khí methane như sau: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ![]() = –890,5 (kJ)
= –890,5 (kJ)
Tính thể tích khí methane (ở điều kiện chuẩn) cần dùng để cung cấp 712,4 kJ nhiệt lượng. Giả sử phản ứng xảy ra hoàn toàn và không có sự thất thoát nhiệt lượng.
Đốt cháy 1 mol CH4(g) tỏa ra nhiệt lượng 890,5 kJ.
Đốt cháy x mol CH4(g) tỏa ra nhiệt lượng 712,4 kJ.
Thể tích khí methane (ở đkc) cần dùng là: 0,8.24,79 = 19,832 (lít)
Phản ứng nào sau đây là phản ứng thu nhiệt?
Phương pháp thăng bằng electron dựa trên nguyên tắc:
Phương pháp thăng bằng electron dựa trên nguyên tắc:
Tổng số electron do chất khử cho bằng tổng số electron mà chất oxi hóa nhận.
Số oxi hóa của các nguyên tử H, Fe, Cl trong H2, Fe2+, Cl- lần lượt là
Áp dụng quy tắc xác định số oxi hóa của các nguyên tử ta có:
Số oxi hóa của các nguyên tử H, Fe, Cl trong H2, Fe2+, Cl- lần lượt là 0; +2; −1.
Trong phản ứng: 2Ag + O3 → Ag2O + O2, vai trò của O3 là
Xét sự thay đổi số oxi hóa của các nguyên tử:
Nguyên tử O trong phân tử O3 nhận electron ⇒ O3 đóng vai trò là chất oxi hóa.
Cho phản ứng: 2Fe(s) + O2(g) → 2FeO(s); ![]() = –544 kJ.
= –544 kJ.
Nhiệt tạo thành chuẩn của FeO là
Phản ứng tạo thành 2 mol FeO có = –544 kJ.
⇒ Phản ứng tạo thành 1 mol FeO có = –544/2 = –272 kJ.
Vậy nhiệt tạo thành chuẩn của FeO là = –272 kJ/mol.
Phản ứng nào chứng tỏ SO2 là chất khử?
Ta có:
Trong phân tử SO2 nguyên tử S nhường electron
SO2 là chất khử.
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Cho phản ứng phân huỷ potassium permanganate:
2KMnO4 ![]() K2MnO4 + MnO2 + O2.
K2MnO4 + MnO2 + O2.
KMnO4 đóng vai trò gì trong phản ứng trên?
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố trong phản ứng:
Nguyên tử Mn trong phân tử KMnO4 nhận electron, nguyên tử O trong KMnO4 nhường electron.
⇒ KMnO4 vừa là chất khử, vừa là chất oxi hóa.
Cho sơ đồ phản ứng : Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Sau khi cân bằng, hệ số lần lượt của các chất là phương án nào sau đây?
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố trước và sau phản ứng:
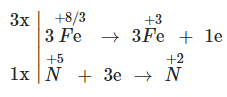
Cân bằng: 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Hệ số cân bằng của các phân tử là: 3, 28, 9, 1, 14
Biết rằng ở điều kiện chuẩn, 1 mol ethanol cháy tỏa ra một nhiệt lượng là 1,37.103 kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng lượng được giải phóng ra dưới dạng nhiệt bởi phản ứng là
1 mol ethanol cháy tỏa ra một nhiệt lượng là 1,37.103 kJ
⇒ mol ethanol cháy tỏa ra một nhiệt lượng là:
.1,37.103 ≈ 0,45.103 kJ ≈ 4,5.102 kJ
Nhiệt kèm theo (nhiệt lượng tỏa ra hay thu vào) của một phản ứng hóa học ở áp suất không đổi (và thường ở một nhiệt độ xác định) gọi là
Nhiệt kèm theo (nhiệt lượng tỏa ra hay thu vào) của một phản ứng hóa học ở áp suất không đổi (và thường ở một nhiệt độ xác định) gọi là biến thiên enthalpy của phản ứng.
Hàm lượng iron (II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O.
Thể tích dung dịch KMnO4 0,01 M cần dùng để phản ứng vừa đủ với 20 ml dung dịch FeSO4 0,1 M là
nFeSO4 = 0,002 (mol)
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
mol: 0,002 → 0,0004
Phát biểu nào sau đây sai?
Phản ứng tỏa nhiệt thì năng lượng của hệ chất phản ứng cao hơn hơn năng lượng của hệ sản phẩm.
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất dạng bền nhất trong điều kiện chuẩn.
Vậy phương trình biểu thị enthalpy tạo thành chuẩn của CO(g) là:
C(than chì) + O2(g) → CO(g).
Để hàn nhanh đường ray tàu hỏa bị hỏng, người ta dùng hỗn hợp tecmit để thực hiện phản ứng nhiệt nhôm sau: 2Al + Fe2O3 → Al2O3 + 2Fe.
Phát biểu nào sau đây sai?
Các quá trình xảy ra:
Al là chất nhường electron ⇒ Al là chất khử (chất bị oxi hóa)
Fe2O3 là chất nhận electron ⇒ Fe2O3 là chất oxi hóa (chất bị khử).
⇒ Tỉ lệ giữa chất bị khử: chất bị oxi hóa là 1:2.
Cho các phản ứng sau:
(1) 2H2S(g) + SO2(g) → 2H2O(g) + 3S(s) ![]() = –237 kJ
= –237 kJ
(2) 2H2S(g) + O2(g) → 2H2O(g) + 2S(s) ![]() = –530,5 kJ
= –530,5 kJ
Enthalpy tạo thành chuẩn của SO2(g) là
Phản ứng tạo thành SO2:
(3) S + O2 → SO2
⇒ (3) =
(2) –
(1)
= (–530,5) – (–237)
= –293,5 kJ
Chất nào sau đây chỉ có tính khử?
Chất chỉ có tính khử khi chỉ có khả năng nhường eletcron.
⇒ Fe là chất chỉ có tính khử.
Ngày nay, dùng cồn trong nấu ăn trở nên rất phổ biến trong các nhà hàng, quán ăn, buổi tổ chức tiệc, liên hoan, hộ gia đình. Một mẫu cồn X chứa thành phần chính là ethanol (C2H5OH) có lẫn methanol (CH3OH). Cho các phương trình nhiệt hóa học sau:
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l) ![]() = −1370 kJ
= −1370 kJ
CH3OH(l) + 3/2O2(g) → CO2(g) + 2H2O(1) ![]() = −716 kJ
= −716 kJ
Biết thành phần 1 viên cồn 70 gam chứa tỉ lệ khối lượng của C2H5OH:CH3OH là 11:1 và chứa 4% tạp chất không cháy. Giả sử để nấu chín một nồi lẩu cần tiêu thụ 3200 kJ, hỏi cần bao nhiêu viên cồn để nấu chín 1 nồi lẩu đó (với hiệu suất hấp thụ nhiệt khoảng 80%)?
Gọi số mol C2H5OH và CH3OH trong mẫu cồn lần lượt là x và y (mol).
Theo bài ra ta có:
Lại có: 1 viên cồn 70 gam và chứa 4% tạp chất không cháy nên:
46x + 32y = 70.96% (2)
Từ (1) và (2) ⇒ x = 1,339, y = 0,175
Nhiệt tỏa ra khi đốt 70 g cồn: 1,339.1370 + 0,175.716 = 1959,73 kJ
Nhiệt hấp thụ được: 1959,73.80% = 1567,784 kJ
Số viên cồn cần dùng là: 3200/1567,784 ≈ 2 viên
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất nhận electron, chất khử là chất nhường electron.
Nhiệt tạo thành chuẩn (![]() ) của các đơn chất ở dạng bền vững nhất là
) của các đơn chất ở dạng bền vững nhất là
Nhiệt tạo thành chuẩn ( ) của các đơn chất ở dạng bền vững nhất là 0 kJ/mol.
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của ít nhất một nguyên tố hóa học.
⇒ Phản ứng là phản ứng oxi hóa khử: 2Ca + O2 2CaO.
Liên kết hydrogen và tương tác van der Waals làm
Liên kết hydrogen và tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
Trong công nghiệp, zinc được điều chế bằng cách nung zinc sulfide trong không khí để tạo thành zinc oxide. Sau đó zinc oxide được nung nóng với carbon để tạo thành zinc. Các phương trình phản ứng xảy ra như sau:
(1) 2ZnS + 3O2 ![]() 2ZnO + 2SO2
2ZnO + 2SO2
(2) ZnO + C ![]() Zn + CO
Zn + CO
Cho các phát biểu sau:
(a) Trong phản ứng (1), ZnS là chất khử do sự thay đổi số oxi hoá của Zn.
(b) Trong phản ứng (2), C bị khử bởi ZnO.
(c) Trong phản ứng (1), O2 bị khử.
(d) Trong cả hai phản ứng, số oxi hoá của Zn đều tăng.
(e) Trong cả hai phản ứng, chất chứa Zn đều là chất khử.
Số phát biểu đúng là
ZnS là chất khử do sự thay đổi số oxi hoá của S và bị oxi hoá; O2 là chất oxi hoá và bị khử
ZnO là chất oxi hoá do sự thay đổi số oxi hoá của Zn và bị khử; C là chất khử và bị oxi hoá
(a) sai.
(b) sai. Trong phản ứng (2), C bị oxi hoá bởi ZnO.
(c) đúng.
(d) sai. Trong phản ứng (1), Zn không thay đổi số oxi hoá. Trong phản ứng (2), số oxi hoá của Zn thay đổi từ +2 xuống 0.
(e) sai. Trong phản ứng (1), ZnS là chất khử. Trong phản ứng (2), ZnO là chất oxi hoá.
Phát biểu nào sau đây sai?
Hầu hết các phản ứng tỏa nhiệt không cần phải tiếp tục đun hoặc đốt nóng ở giai đoạn tiếp diễn.
Quy tắc xác định số oxi hoá nào sau đây không đúng?
Trong hợp chất, số oxi hóa của O là –2 (trừ mộ số trường hợp như: OF2, H2O2,...).
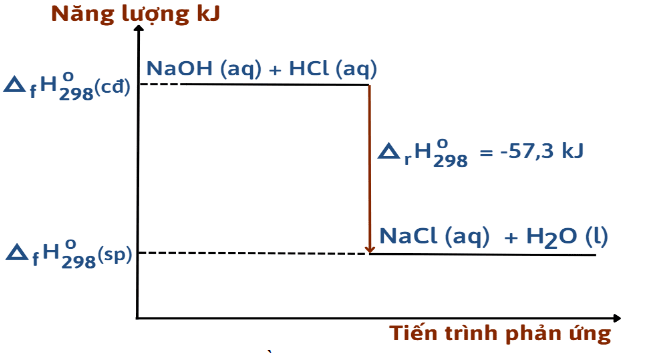
Dựa vào sơ đồ ta có phương trình nhiệt hóa học ứng với sơ đồ trên là:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) = -57,3 kJ.
Cho nhiệt tạo thành tiêu chuẩn ở 25oC của các chất NH3, NO, H2O lần lượt bằng: –46,3; +90,4 và –241,8 kJ/mol. Hãy tính hiệu ứng nhiệt của phản ứng:
2NH3 + ![]() O2 → 2NO + 3H2O
O2 → 2NO + 3H2O
Tính biến thiên enthalpy của phản ứng theo công thức:
=
(sp) –
(cđ)
= 2.90,4 – 3.241,8 – (–2.46,3)
= –452 kJ.
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn tỏa ra 184,62 kJ:
H2(g) + Cl2(g) ⟶ 2HCl(g) (*)
Những phát biểu nào dưới đây đúng?
(1) Enthalpy tạo thành chuẩn của HCl(g) là − 184,62 kJ/mol.
(2) Biến thiên enthalpy chuẩn của phản ứng (*) là − 184,62 kJ.
(3) Enthalpy tạo thành chuẩn của HCl(g) là – 92,31 kJ/mol.
(4) Biến thiên enthalpy chuẩn của phản ứng (*) là 184,62 kJ.
(1) Enthalpy tạo thành chuẩn của HCl(g) là − 184,62 kJ/mol ⇒ sai vì − 184,62 kJ/mol là nhiệt tạo thành của 2 mol HCl (g).
(2) Biến thiên enthalpy chuẩn của phản ứng (*) là − 184,62 kJ ⇒ đúng vì biến thiên enthalpy chuẩn của phản ứng là lượng nhiệt kèm theo của phản ứng đó trong điều kiện chuẩn mà phản ứng tỏa nhiệt nên < 0.
(3) Enthalpy tạo thành chuẩn của HCl(g) là – 92,31 kJ/mol ⇒ đúng.
(4) Biến thiên enthalpy chuẩn của phản ứng (*) là 184,62 kJ ⇒ sai vì phản ứng tỏa nhiệt nên < 0.
Quá trình Ostwald dùng để sản xuất nitric acid từ ammonia được đề xuất vào năm 1902. Ở giai đoạn đầu của quá trình, ammonia bị oxi hoá bởi oxygen ở nhiệt độ cao khi có chất xúc tác:
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
Chất bị oxi hoá trong quá trình trên là
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố:
Ta thấy nguyên tử N trong phân tử NH3 nhường electron NH3 là chất khử hay là chất bị oxi hóa.
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Phản ứng giữa Mg và dung dịch H2SO4 loãng có thể tự xảy ra ở điều kiện thường.
Các phản ứng còn lại cần cung cấp nhiệt thì phản ứng mới xảy ra.
Mỗi quá trình sau đây là thu nhiệt hay tỏa nhiệt?
(1) H2O (lỏng, ở 25oC) ![]() H2O (hơi, ở 100oC)
H2O (hơi, ở 100oC)
(2) H2O (lỏng, ở 25oC) ![]() H2O (rắn, ở 0oC).
H2O (rắn, ở 0oC).
(3) CaCO3 (đá vôi) ![]() CaO + CO2
CaO + CO2
(4) Khí methane (CH4) cháy trong oxygen.
- Phản ứng giải phóng năng lượng dưới dạng nhiệt là phản ứng tỏa nhiệt;
- Phản ứng hấp thụ năng lượng dưới dạng nhiệt là phản ứng thu nhiệt.
Như vậy:
Quá trình (1) thu nhiệt;
Quá trình (2) tỏa nhiệt;
Quá trình (3) thu nhiệt;
Quá trình (4) tỏa nhiệt.
Cho sơ đồ chuyển hóa của sulfur như sau:
S ![]() SO2
SO2 ![]() SO3
SO3 ![]() H2SO4
H2SO4 ![]() SO2
SO2
Mỗi mũi tên là một phản ứng hóa học. Có bao nhiêu phản ứng là phản ứng oxi hóa - khử?
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của ít nhất một nguyên tố hóa học.
⇒ Các phản ứng oxi hóa khử là: S SO2; SO2
SO3; H2SO4
SO2.
Cho phương trình nhiệt hóa học của phản ứng trung hòa sau:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) ∆H = –57,3 kJ
Phát biểu nào sau đây không đúng?
Theo bài ra ta có: ∆H = –57,3 kJ < 0
⇒ Phản ứng tỏa nhiệt.
Từ phương trình ta thấy 1 mol HCl tác dụng với 1 mol NaOH.
Nhưng vậy cho 1 mol HCl tác dụng với 1 mol NaOH tỏa nhiệt lượng là 57,3 kJ.
Cho các chất và ion sau: ClO4-, ClO-, Cl2, ClO3-. Thứ tự theo chiều tăng dần về số oxi hóa của Cl là:
- Với ClO4-: Gọi số oxi hóa của Cl là x
⇒ 1.x + 4.(-2) = -1 ⇒ x = +7
- Với ClO3-: Gọi số oxi hóa của Cl là y
⇒ 1.x + 3.(-2) = -1 ⇒ x = +5
- Với ClO-: Gọi số oxi hóa của Cl là z
⇒ 1.x + 1.(-2) = -1 ⇒ x = +1
- Với Cl2: Số oxi hóa của Cl là 0
⇒ Thứ tự theo chiều tăng dần về số oxi hóa của Cl là Cl2, ClO-, ClO3-, ClO4-.
