Cho 1,8 gam kim loại Mg tác dụng với dung dịch nitric acid đặc, nóng, dư thu được V lít khí NO (ở 25oC, 1 bar, là chất khí duy nhất) và muối Mg(NO3)2. Giá trị của V là
nMg = 0,075 (mol)
Sơ đồ phản ứng: Mg + HNO3 → Mg(NO3)2 + NO + H2O
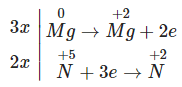
Phương trình cân bằng là:
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
Tính toán theo phương trình hóa học:
⇒ VNO = 0,05.24,79 = 1,2395 lít