Trong phản ứng hóa học: 2Al + 6HCl → 2AlCl3 + 3H2, mỗi nguyên tử Al đã
Trong phản ứng xảy ra quá trình:
⇒ Mỗi nguyên tử Al đã nhường 3 electron.
Trong phản ứng hóa học: 2Al + 6HCl → 2AlCl3 + 3H2, mỗi nguyên tử Al đã
Trong phản ứng xảy ra quá trình:
⇒ Mỗi nguyên tử Al đã nhường 3 electron.
Biến thiên enthalpy chuẩn được xác định ở nhiệt độ nào?
Biến thiên enthapy chuẩn là nhiệt tỏa ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ là 25oC (298K).
Khi calcium phản ứng với nước, nhiệt độ thay đổi từ 18oC đến 39oC. Phản ứng của calcium với nước là
Khi calcium phản ứng với nước, nhiệt độ thay đổi từ 18oC đến 39oC ⇒ Phản ứng có sự giải phóng nhiệt năng ra môi trường ⇒ phản ứng tỏa nhiệt.
Điều chế NH3 từ N2(g) và H2(g) làm nguồn chất tải nhiệt, nguồn để điều chế nitric acid và sản xuất phân urea. Xác định nhiệt tạo thành chuẩn của NH3, biết khi sử dụng 7 gam khí N2 sinh ra 22,95 kJ nhiệt.
nN2 = 0,25 (mol)
N2(g) + 3H2(g) → 2NH3(g)
Ta có: 0,25 mol N2 phản ứng sinh ra 22,95 kJ nhiệt.
⇒ 1 mol N2 phản ứng sinh ra = 91,8 kJ nhiệt.
⇒ Cứ 2 mol NH3 tạo thành sinh ra 91,8 kJ nhiệt.
Vậy: 1 mol NH3 tạo thành sinh ra = 45,9 kJ nhiệt.
Phản ứng tỏa nhiệt nên: = –45,9 kJ.
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của NH3(g)?
Phương trình hóa học biểu thị enthalpy tạo thành chuẩn của NH3(g) là:
N2(g) +
H2(g) → NH3(g).
Một số khu vực trên thế giới như miền nam California và Ả Rập Saudi đang rơi vào tình trạng thiếu nước ngọt để uống. Một giải pháp khả thi cho vấn đề là đưa các tảng băng trôi khỏi Nam cực và sau đó làm tan chảy chúng khi cần thiết. Nếu biến thiên enthalpy chuẩn của chuyển hóa băng trôi thành nước là 6,01 kJ/mol đối với phản ứng ở 0oC và áp suất không đổi H2O(s) → H2O(l). Cần bao nhiêu năng lượng để làm tan chảy một tảng băng lớn vừa phải có khối lượng 1,00 triệu tấn?
H2O(s) → H2O(l) = 6,01 kJ/mol
Để làm tan chảy 1 mol H2O(s) cần 6,01 kJ/mol.
⇒ Để làm tan chảy 5,555.1010 mol H2O(s) cần 6,01.5,555.1010 ≈ 3,34.1011 kJ/mol.
Hợp chất nào sau đây lưu huỳnh có số oxi hóa +6?
Gọi số oxi hóa của S trong mỗi hợp chất là x. Áp dụng quy tắc xác định số oxi hóa của nguyên tử các nguyên tố ta có:
- H2S: x + (+1).2 = 0 ⇒ x = –2
- Na2SO4: 2.(+1) + x + (–2).4 = 0 ⇒ x = +6
- SO2: x + (–2).2 = 0 ⇒ x = +4
- Na2SO3: (+1).2 + x + (–2).3 = 0 ⇒ x = +4
Vậy S có số oxi hóa +6 trong hợp chất Na2SO4.
Xác định biến thiên enthalpy (![]() ) của phản ứng đốt cháy butane:
) của phản ứng đốt cháy butane:
C4H10(g) + ![]() O2(g) → 4CO2(g) + 5H2O(g)
O2(g) → 4CO2(g) + 5H2O(g)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau:
| Liên kết | Phân tử | Eb (kJ/mol) | Liên kết | Phân tử | Eb (kJ/mol) |
| C – C | C4H10 | 346 | C = O | CO2 | 799 |
| C – H | C4H10 | 418 | O – H | H2O | 467 |
| O = O | O2 | 495 |
C4H10(g) + O2(g) → 4CO2(g) + 5H2O(g)
=
Eb(cđ) –
Eb(sp)
= 3.EC – C + 10.EC – H + 6,5.EO=O – 4.2.EC = O – 5.2.EO – H
= 3.346 + 10.418 + 6,5.495 – 8.799 – 10.467
= –2626,5 (kJ)
Tính ![]() của phản ứng khi biết các giá trị năng lượng liên kết (Eb) được áp dụng trong điều kiện nào?
của phản ứng khi biết các giá trị năng lượng liên kết (Eb) được áp dụng trong điều kiện nào?
Tính của phản ứng khi biết các giá trị năng lượng liên kết (Eb) được áp dụng khi các chất đều có liên kết cộng hóa trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng .
Phát biểu nào sau đây không đúng?
Sự phá vỡ liên kết cần cung cấp năng lượng, sự hình thành liên kết giải phóng năng lượng.
Đốt cháy quặng magnesium rồi cho vào bình chứa khí CO2 thì thấy phản ứng tiếp tục xảy ra và sản phẩm tạo thành là bột trắng và muội đen. Phát biểu nào sau đây sai?
Mg chuyển tử số oxi hóa 0 lên + 2.
Nhiệt lượng tỏa ra từ quá trình đốt cháy 6,44 gam sulfur trong oxygen theo phương trình: 2S(s) + 3O2(g) ![]() 2SO3(l)
2SO3(l) ![]() = –791,4 kJ có giá trị là
= –791,4 kJ có giá trị là
nS = 0,20125 (mol)
Nhiệt lượng tỏa ra từ quá trình đốt cháy 2 mol S là 791,4 kJ.
⇒ Nhiệt lượng tỏa ra từ quá trình đốt cháy 0,20125 mol S là:
Nguyên tử sulfur chỉ thể hiện tính khử (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây?
Trong hợp chất H2S, S có số oxi hóa –2, là số oxi hóa thấp nhất của lưu huỳnh nên chỉ thể hiện tính khử.
Cho đinh sắt vào ống nghiệm chứa 3 ml HCl, sắt phản ứng với HCl theo phương trình hoá học sau: Fe + 2HCl → FeCl2 + H2. Nhận xét nào sau đây là đúng?
Phương trình phản ứng: Fe + 2HCl → FeCl2 + H2
Các quá trình xảy ra:
: Đây là quá trình nhận electron nên là quá trình khử. Ion H+ nhận electron nên là chất oxi hoá.
: Đây là quá trình nhường electron nên là quá trình oxi hóa. Fe nhường electron nên là chất khử.
Phản ứng oxi hóa - khử là
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự dịch chuyển electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một nguyên tử trong phân tử.
Hòa tan 0,1 mol Al và 0,3 mol Mg trong dung dịch H2SO4 đặc, nóng, dư thì thu được V lít khí SO2 (đkc, sản phẩm khử duy nhất của S+6). Giá trị của V bằng bao nhiêu?
Quá trình nhường - nhận electron:
mol: 0,3 → 0,6 mol: x ← 2x
mol: 0,1 → 0,3
2x = 0,6 + 0,3
⇒ x = 0,45 (mol)
⇒ V = 0,45.24,79 = 11,1555 (lít)
Cho các phát biểu sau, phát biểu đúng là:
- Chất oxi hoá (chất bị khử) thường là O2 trong phản ứng cháy.
- Một số phản ứng trong công nghiệp không phải phản ứng oxi hóa khử. Ví dụ: phản ứng nung CaCO3 trong quy trình sản xuất vôi sống không phải phản ứng oxi hoá - khử.
- Các phản ứng oxi hoá - khử gây gỉ sét là phản ứng có hại.
- Trong phản ứng đốt cháy khí thiên nhiên thì khí thiên nhiên đóng vai trò là chất bị oxi hóa.
Cho phản ứng có dạng: aA(g) + bB(g) ⟶ mM(g) + nN(g)
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết Eb là
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết Eb là:
= a.Eb(A) + b.Eb(B) – m.Eb(M) – n.Eb(N).
Hiện tượng thực tiễn nào sau đây không phải phản ứng oxi hóa – khử?
Mưa là các giọt nước lỏng ngưng tụ từ hơi nước trong khí quyển rồi trở nên đủ nặng để rơi xuống đất dưới tác động của trọng lực ⇒ không xảy ra phản ứng oxi hóa khử.
Hydrogen peroxide, H2O2 được sử dụng để cung cấp lực đẩy cho tên lửa do dễ dàng bị phân hủy theo phương trình: 2H2O2(l) → 2H2O(g) + O2(g). Lượng nhiệt được tạo ra khi phân hủy chính xác 1 mol H2O2 ở điều kiện chuẩn là (biết nhiệt tạo thành chuẩn của H2O(g) = –241,8 kJ/mol; H2O2(l) = –187,8 kJ/mol)
2H2O2(l) → 2H2O(g) + O2(g)
=
(O2) + 2.
(H2O) – 2.
(H2O2)
⇒ = 0 + 2.(–241,8) – 2.(–187,8)
= –108 (kJ)
Phân hủy 2 mol H2O2 tạo ra lượng nhiệt là 108 kJ.
⇒ Phân hủy 1 mol H2O2 tạo ra lượng nhiệt là 108 : 2 = 54 kJ.
Xét phản ứng: MnO2 + 4HCl ![]() MnCl2 + Cl2 + H2O
MnCl2 + Cl2 + H2O
Phát biểu nào sau đây không đúng?
Cứ 4 phân tử HCl tham gia phản ứng thì 2 phân tử đóng vai trò là chất khử, hai phân tử đóng vai trò là chất tạo môi trường.
Cho các quá trình sau:
a) Nước hóa rắn.
b) Sự tiêu hóa thức ăn.
c) Quá trình chạy của con người.
d) Khí CH4 đốt ở trong lò.
Các quá trình tỏa nhiệt là
a) Nước hoá rắn là quá trình toả nhiệt.
b) Sự tiêu hoá thức ăn là quá trình thu nhiệt.
c) Quá trình chạy của con người là quá trình toả nhiệt.
d) Khí CH4 đốt ở trong lò là quá trình toả nhiệt.
Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phương trình hóa học của phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố:
Thăng bằng electron:
⇒ Cân bằng phương trình phản ứng:
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Vậy khi hệ số của FeO là 3 thì hệ số của HNO3 là 10.
Cho 30,3g hỗn hợp Al và Zn tác dụng vừa đủ với 11,15 lít O2 (đkc) thu được hỗn hợp các oxide. Tính tổng khối lượng các oxide tạo thành.
nO2 = 0,45 mol
Đặt số mol của Al, Zn lần lượt là x, y (mol)
⇒ mhh = 27x + 65y = 30,3 (1)
Phương trình hóa học:
4Al + 3O2 → 2Al2O3
mol: x → 3x/4
2Zn + O2 → 2ZnO
mol: y → y/2
Từ (1) và (2) suy ra: x = 0,4; y = 0,3
⇒ nAl2O3 = .nAl = 0,2 mol; nZnO = nZn = 0,3 mol
⇒ moxide = mAl2O3 + mZnO = 0,2.102 + 0,3.81 = 44,7 (gam)
Trong quá trình Ostwald dùng để sản xuất nitric acid từ ammonia, được đề xuất vào năm 1902. Ở giai đoạn đầu của quá trình xảy ra phản ứng sau:
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
Chất khử là
Sự thay đổi số oxi hóa của các nguyên tử trong phản ứng:
Phân tử NH3 có nguyên tử N nhường eletron ⇒ NH3 là chất khử.
Phát biểu nào dưới đây là sai khi nói về phản ứng tỏa nhiệt?
Phản ứng tỏa nhiệt là phản ứng trong đó có sự giải phóng nhiệt năng ra môi trường.
Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do
Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
Cho 17,4 gam MnO2 tác dụng với dung dịch HCl đặc, dư theo sơ đồ phản ứng sau:
MnO2 + HCl ![]() MnCl2 + Cl2↑ + H2O.
MnCl2 + Cl2↑ + H2O.
Số mol HCl bị oxi hóa là
nMnO2 = 0,2 mol
MnO2 + HCl MnCl2 + Cl2↑ + H2O
Quá trình nhường nhận electron:
mol: 0,2 → 0,4
mol: 0,4 ← 0,4
⇒ Số mol HCl bị oxi hóa là 0,4 mol.
Một hộ gia đình mua than đá làm nhiên liệu đun nấu và trung bình mỗi ngày dùng hết 1,8 kg than. Giả thiết loại than đá trên chứa 91,333% cacbon và 0,542% lưu huỳnh về khối lượng, còn lại là các tạp chất trơ. Cho các phản ứng cháy của carbon và lưu huỳnh sau:
C(s) + O2(g) ![]() CO2(g)
CO2(g)
S(s) + O2(g) ![]() SO2(g)
SO2(g)
Biết đốt cháy 1 mol carbon tỏa ra lượng nhiệt là 393,5 kJ và 1 mol lưu huỳnh tỏa ra lượng nhiệt là 296,8 kJ. Nhiệt lượng cung cấp cho hộ gia đình từ quá trình đốt than trong một ngày tương đương bao nhiêu số điện (1 số điện = 1 kWh = 3600 kJ)?
Lượng nhiệt khi dốt cháy 1800 gam than là:
137.393,5 + 0,305.296,8 = 54000 kJ
Nhiệt lượng tương đương với số điện là:
= 15 số điện
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) → 2NO(g) ![]() = +180kJ
= +180kJ
Kết luận nào sau đây đúng?
Phản ứng có: > 0 ⇒ Phản ứng là phản ứng thu nhiệt, khi xảy ra có sự hấp thụ nhiệt từ môi trường.
Phản ứng xảy ra khi pin được sử dụng trong điện thoại, máy tính, … giải phóng năng lượng dưới dạng
Phản ứng xảy ra khi pin được sử dụng trong điện thoại, máy tính, … giải phóng năng lượng dưới dạng điện năng.
Phát biểu nào sau đây đúng với phản ứng sau?
2Fe + 3CO2 → Fe2O3 + 3CO ![]() = +26,6 kJ
= +26,6 kJ
= +26,6 kJ > 0 ⇒ Phản ứng là phản ứng thu nhiệt (hấp thụ nhiệt).
Cứ 2 mol Fe phản ứng thì có 26,6 kJ nhiệt được hấp thụ.
⇒ 1 mol Fe phản ứng thì có 13,3 kJ nhiệt được hấp thụ.
Cảnh sát giao thông sử dụng các dụng cụ phân tích rượu etylic có chứa CrO3. Khi tài xế hà hơi thở vào dụng cụ phân tích trên, nếu trong hơi thở có chứa hơi rượu thì hơi rượu sẽ tác dụng với CrO3 có màu da cam và biến thành Cr2O3 có màu xanh đen theo phản ứng hóa học sau:
CrO3 + C2H5OH → CO2↑ + Cr2O3 + H2O
Tỉ lệ chất khử : chất oxi hoá ở phương trình hóa học trên là
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố trong phản ứng:
Các quá trình xảy ra:
⇒ Chất khử là C2H5OH, chất oxi hóa là CrO3
Cân bằng phương trình phản ứng: 4CrO3 + C2H5OH → 2CO2↑ + 2Cr2O3 + 3H2O
⇒ Tỉ lệ chất khử : chất oxi hoá là 1 : 4.
Cho các phát biểu sau:
(a) Số oxi hóa của nguyên tử trong đơn chất bằng 0.
(b) Số oxi hóa của kim loại kiềm trong hợp chất là +1.
(c) Số oxi hóa của oxygen trong OF2 là –2.
(d) Trong hợp chất, hydrogen luôn có số oxi hóa là +1.
Số phát biểu đúng là:
Theo quy tắc xác định số oxi hóa của các nguyên tử nguyên tố ta có:
(a) Đúng.
(b) Đúng.
(c) Sai. Số oxi hóa của oxygen trong hợp chất OF2 là +2.
(d) Sai. Trong đa số các hợp chất, hydrogen có số oxi hóa là +1 trừ các hydride kim loại như NaH, CaH2,...
Vậy có 2 phát biểu đúng.
Cho các chất sau, chất nào có nhiệt tạo thành chuẩn bằng 0?
Các đơn chất bền có enthalpy tạo thành chuẩn bằng 0.
⇒ N2(g) có enthalpy tạo thành chuẩn bằng 0.
Số oxi hóa của N trong NxOy là
Số oxi hóa của O là –2.
Gọi số oxi hóa của N là a. Áp dụng quy tắc xác định số oxi hóa của các nguyên tử nguyên tố ta có:
a.x + (–2.y) = 0 ⇒ a =
Giản đồ biến thiên enthalpy chuẩn của phản ứng giữa methane và oxygen được biểu diễn ở hình dưới đây:
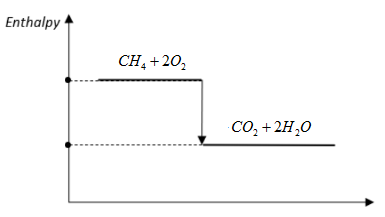
Phát biểu nào sau đây không đúng khi nói về phản ứng trong hình?
Theo đề bài thì chất đầu là CH4 và O2, sản phẩm là CO2 và H2O.
Có phản ứng toả nhiệt (ΔH < 0) có sơ đồ biến thiên enthalpy như sau:
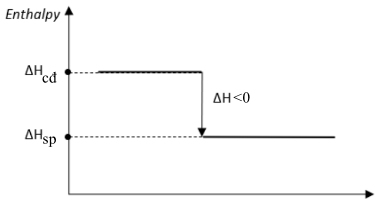
⇒ Phản ứng giữa methane và oxygen là phản ứng toả nhiệt.
Một số loại xe ô tô được trang bị một thiết bị an toàn là túi chứa một lượng nhất định hợp chất ion sodium azide (NaN3), được gọi là "túi khí". Khi có va chạm mạnh xảy ra, sodium azide bị phân huỷ rất nhanh, giải phóng khí N2 và nguyên tố Na, làm túi phồng lên, bảo vệ được người trong xe tránh khỏi thương tích. Phương trình hóa học của phản ứng phân hủy sodium azide là
Khi có va chạm mạnh xảy ra, sodium azide bị phân huỷ rất nhanh, giải phóng khí N2 và nguyên tố Na ⇒ Sơ đồ phản ứng là:
NaN3 Na + N2
⇒ Cân bằng phản ứng: 2NaN3 → 2Na + 3N2
Phát biểu nào sau đây về nhiệt tạo thành là không đúng?
Kí hiệu nhiệt tạo thành chuẩn là
Enthalpy tạo thành chuẩn của một chất được kí hiệu là ![]() , là lượng nhiệt kèm theo khi phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn. Khi phản ứng tỏa nhiệt thì
, là lượng nhiệt kèm theo khi phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn. Khi phản ứng tỏa nhiệt thì
Khi phản ứng tỏa nhiệt thì < 0.
Khi phản ứng thu nhiệt thì > 0.
