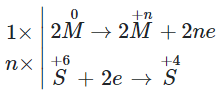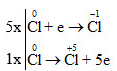Cho phương trình hoá học: Cu + HNO3 Cu(NO3)2 + NO + H2O. Tổng hệ số cân bằng (nguyên, tối giản) của phản ứng là
Cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng electron
Xác định sự thay đổi số oxi hóa
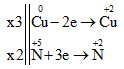
Vậy 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Tổng hệ số cân bằng (nguyên, tối giản) của phản ứng là: 3 + 8 + 3 + 2 + 4 = 20