Cho quá trình: 2Cr 6+ + 6e → 2Cr+3. Đây là quá trình:
2Cr 6+ + 6e → 2Cr+3. Đây là quá trình khử
Cho quá trình: 2Cr 6+ + 6e → 2Cr+3. Đây là quá trình:
2Cr 6+ + 6e → 2Cr+3. Đây là quá trình khử
Cho enthalpy tạo thành chuẩn của các chất tương ứng trong bảng sau
|
Chất |
N2O4 (g) |
NO2 (g) |
|
|
9,16 |
33,20 |
Tính biến thiên enthalpy của phản ứng sau: 2NO2 (g) → N2O4 (g)
=
Cho phản ứng 5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4. (Hệ số cân bằng của phương trình là các số nguyên tối giản). Hệ số cân bằng của K2SO4 là:
Xác định sự thay đổi số oxi hóa
|
Quá trình oxi hóa: ×5 Quá trình khử: ×2 |
S+4 → S+6 + 2e Mn+7 +5e → Mn+2 |
Đặt hệ số cân bằng, ta được phương trình phản ứng:
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
Trong phản ứng tỏa nhiệt, biến thiên enthalpy chuẩn luôn nhận giá trị
Trong phản ứng tỏa nhiệt, biến thiên enthalpy chuẩn luôn nhận giá trị âm.
Phát biểu nào sau đây không đúng?
Các phản ứng tỏa nhiệt như CO2 + CaO → CaCO3 , phản ứng lên men, ... khó xảy ra hơn khi đun nóng.
Trong các phản ứng sau, phản ứng nào không phải là phản ứng oxi hóa - khử:
Phản ứng không phải là phản ứng oxi hoá - khử là phản ứng không làm thay đổi số oxi hóa các chất
BaCl2 + H2SO4 → BaSO4 + 2HCl
là phản ứng trao đổi
Loại phản ứng nào sau đây luôn luôn không phải là phản ứng oxi hóa - khử.
Loại phản ứng luôn luôn không phải là phản ứng oxi hóa - khử là phản ứng trao đổi (vô cơ)
Ví dụ:
NaOH + HCl → NaCl + H2O
Điều nào đúng khi nói về vai trò của các chất tham gia sơ đồ phản ứng oxi hóa khử sau?
KMnO4 + HCl ![]() KCl + MnCl2 + Cl2 + H2O
KCl + MnCl2 + Cl2 + H2O
Chất khử (chất bị oxi hóa) là chất nhường electron
Chất oxi hóa (chất bị khử) là chất nhận electron
Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron
Quá trình khử (sự khử) là quá trình thu electron
Xác định sự thay đổi số oxi hóa của các nguyên tố
HCl là chất khử
KMnO4 là chất oxi hóa
|
x5 x2 |
|
⇒ 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Số oxi hóa của nitrogen trong NH4+, N2O, HNO3, lần lượt là:
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitrogen trong NH4+, N2O, và HNO3Ta có:
x + 4 .1 = 1 ⇒ x = - 3.
⇒ Số oxi hóa của N trong NH4+ là -3
2.y + 1.(-2) = 0 ⇒ y = +1.
⇒ Số oxi hóa của N trong N2O là +1
z + 1 + 3.(-2) = 0 ⇒ z = 5.
⇒ Số oix hóa của N trong HNO3 là +5
Bình “gas” sử dụng trong một hộ gia đình có chứa 12 kg khí hóa lỏng (LPG) gồm propane (C3H8) và butane (C4H10) với tỉ lệ mol tương ứng là 2 : 3. Khi được đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2850 kJ (sản phẩm gồm H2O ở trạng thái lỏng và khí CO2). Trung bình, lượng nhiệt tiêu thụ từ' đốt khí “gas” của hộ gia đình Y là 10 000 kJ/ngày và hiệu suất sử dụng nhiệt là 67,3%. Sau bao nhiêu ngày hộ gia đình sẽ sử dụng hết bình gas trên?
C3H8(g) + 5O2(g) → 3CO2 (g) + 4H2O(l) = –2220 kJ
2C4H10(g) + 13O2(g) → 8CO2(g) + 10H2O(l) = 2850 kJ
Gọi số mol propane (C3H8) và butane (C4H10) trong bình gas lần lượt là x và y (mol):
Vì tỉ lệ thể tích cũng chính là tỉ lệ số mol nên:
mbình gas = 44x + 57y = 12 (2)
Từ (1) và (2)
Nhiệt tỏa ra khi đốt bình ga 12 kg là:
Với hiệu suất sử dụng nhiệt là 67,3% thì lượng nhiệt hiệu dụng
Số ngày dùng hết bình ga:
Cho phản ứng hóa học: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag. Trong phản ứng trên
Quá trình nhường electron là sự oxi hóa, quá trình nhận electron là sự khử
Cu là chất khử,
Ag+ là chất oxi hóa.
⇒ Cu bị oxi hóa thành Cu2+, Ag+ bị khử thành Ag
Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa - khử?
Xác định sự thay đổi số oxi hóa của các nguyên tố
Phản ứng Fe + S → FeS là phản ứng oxi hóa – khử, do có sự thay đổi số oxi hóa của một số nguyên tố sau phản ứng.
Dựa vào phương trình nhiệt hoá học của phản ứng sau:
3Fe (s) + 4H2O (l) → Fe3O4 (s) + 4H2 (g) = +26,32 kJ
Giá trị ![]() của phản ứng:
của phản ứng:
Fe3O4 (s) + 4H2 (g) → 3Fe (s) + 4H2O (l) là
Khi đảo chiều phản ứng thì giá trị cũng là giá trị đối so với giá trị ban đầu
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2 (g) + O2 (g) ⟶ 2NO (g) ![]() = +180 kJ
= +180 kJ
Kết luận nào sau đây đúng?
> 0 ⇒ Phản ứng thu nhiệt
Lời giải:
Ta có: = +180 kJ > 0
⇒ Phản ứng hấp thụ nhiệt năng từ môi trường
Phản ứng tỏa nhiệt là gì?
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Cho phản ứng: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl. Trong đó, Cl2 đóng vai trò là
Chất khử: H2S;
Chất oxi hóa: Cl2
Quy tắc xác định số oxi hoá nào sau đây là không đúng?
Oxygen luôn có số oxi hoá là -2 chưa chính xác vì
Trường hợp ngoại lệ :
Số oxi hóa -1: H2O2, Na2O2
Số oxi hóa +2: OF2
Trong các quá trình sao quá trình nào là quá trình thu nhiệt?
Nước bị bay hơi là quá trình thu nhiệt
Số oxi hóa của nguyên tố Mn trong hợp chất K2MnO4 là:
Gọi số oxi hóa của nguyên tử Mn là x, theo quy tắc 1 và 2 về xác định số oxi hóa, ta có:
Trong phân tử K2MnO4: 2.(+1) + x + 4.(-2) = 0 ⇔ x = +6
Hòa tan hoàn toàn x mol Mg bằng dung dịch HNO3 đặc, nóng (dư) sinh ra y mol NO2 (sản phẩm khử duy nhất của N+5 ). Biểu thức liên hệ giữa x và y là
nMg = x mol
nNO2 = y mol
Quá trình nhường nhận electron
Mg0 → Mg2+ + 2e
x → 2x
N+5 + 1e → N+4
y ← y
Áp dụng bảo toàn electron:
2x = y
Cho 2 quá trình:
(1) Zinc dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với Zinc dạng lá.
(2) Để thực phẩm trong tủ lạnh giúp cho thực phẩm dược tươi lâu hơn.
Yếu tố nào đã ảnh hưởng đến tốc độ phản ứng của 2 quá trình trên?
(1) Zinc dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với Zinc dạng lá ⇒ Diện tích tiếp xúc
(2) Để thực phẩm trong tủ lạnh giúp cho thực phẩm dược tươi lâu hơn ⇒ Nhiệt độ
Cho các phản ứng sau:
(a) Ca(OH)2 + Cl2 → CaOCl2 + H2O
(b) 2KOH + 2NO2 → KNO2 + KNO3 + H2O
(c) O3 + 2Ag → Ag2O + O2
(d) 2H2S + SO2 → 3S + 2H2O
(e) 2KMnO4 → K2MnO4 + MnO2 + O2
(g) NaCl + AgNO3 → NaNO3 + AgCl
Số phản ứng oxi hoá – khử là
Trong phản ứng
(a) Số oxi hoá của Cl thay đổi từ 0 sang -1; +1
(b) Số oxi hoá của N thay đổi từ +4 sang +5; +3
(c) Số oxi hoá của O thay đổi từ 0 xuống -2; số oxi hoá của Ag thay đổi từ 0 lên +1
(d) Số oxi hoá của Cl thay đổi từ -2; +4 sang 0
(e) Số oxi hoá của Mn thay đổi từ +7 sang +6 và +4, số oxi hoá của O thay đổi từ -2 lên 0
(g) Là phản ứng trao đổi nên không có sự thay đổi số oxi hóa trong các nguyên tố
Khi ninh (hầm) thịt cá, người ta sử dụng những cách sau.
(1) Dùng nồi áp suất
(2) Cho thêm muối vào.
(3) Chặt nhỏ thịt cá.
(4) Nấu cùng nước lạnh.
Cách làm cho thịt cá nhanh chín hơn là:
Khi ninh (hầm) thịt cá, người ta sử dụng những cách sau cho thịt cá nhanh chín hơn
(1) Dùng nồi áp suất
(2) Cho thêm muối vào.
(3) Chặt nhỏ thịt cá.
Khi cho cùng một lượng aluminium vào cốc đựng dung dịch acid HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng aluminium ở dạng nào sau đây?
Khi cho cùng một lượng aluminium vào cốc đựng dung dịch acid HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng aluminium ở dạng bột mịn, khuấy đều
Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng chỉ có chất rắn?
Áp suất không ảnh hưởng đến tốc độ của phản ứng chỉ có chất rắn
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng:
Tỉ lệ mol của các chất trong phản ứng không ảnh hưởng đến tốc độ phản ứng
Xét phản ứng: MnO2 + 4HCl → MnCl2 + Cl2 + H2O. Phát biểu nào sau đây không đúng?
Phương trình phản ứng:
MnO2 là chất oxi hóa
HCl là chất khử
Cứ 4 phân tử HCl tham gia phản ứng thì 2 phân tử đóng vai trò là chất khử, hai phân tử đóng vai trò là chất tạo môi trường.
Cho phương trình hoá học của phản ứng: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Tính biến thiên enthalpy của phản ứng trên? Cho biết nhiệt tạo thành chuẩn của các chất như sau:
| Chất | CH4 (g) | CO2 (g) | H2O (l) |
| - 74,87 | − 393,5 | -285,84 |
Tổng nhiệt tạo thành các chất đầu là:
Biến thiên enthalpy của phản ứng là:
= –965,18 – (74,87) = – 890,31 kJ
Hòa tan hoàn toàn 7,2 gam Magnesium vào dung dịch nitric acid loãng. Tính thể tích khí nitrogen monooxide (NO) tạo thành ở điều kiện chuẩn?
nMg = 7,2 : 24 = 0,3 mol
Quá trình trao đổi electron
|
Mg0 → Mg+2 + 2e 0,3 → 0,6 mol |
N+5 + 3e → N+2 3x ← x |
Áp dụng định luật bảo toàn e:
3x = 0,6 ⇒ x = 0,2 mol
Thể tích khí NO thu được ở đkc là:
VNO = 0,2.24,79 = 4,958 L.
Chất hay ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là:
Các chất vừa có tính khử vừa có tính oxi hóa là: FeO
Ví dụ:
Các chất chỉ có tính oxi hóa: F2, Ag+
Các chất chỉ có tính khử: Cl-
Trong phản ứng: Cu + 2H2SO4(đặc, nóng) → CuSO4 + SO2 + 2H2O, sulfuric acid
S+6 → S+4 ⇒ H2SO4 đóng vai trò là chất oxi hóa
Mặt khác SO42- đóng vai trò môi trường để tạo muối CuSO4
Phản ứng nào sau đây vừa là phản ứng hóa hợp, vừa là phản ứng oxi hóa – khử?
Phản ứng hóa hợp là phản ứng từ nhiều chất tham gia tạo thành 1 chất mới
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
Vậy 4Fe(OH) 2 + O2 + 2H2O → 4Fe(OH)3 vừa là phản ứng hóa hợp vừa là phản ứng oxi hóa khử
Số oxi hóa của chlorine ở hợp chất nào sau đây có số oxi hóa +5?
Trong các hợp chất: NaOCl, NaClO2, NaClO3, NaClO4 thì Na có số oxi hóa là +1; O có số oxi hóa là -2.
Áp dụng quy tắc hóa trị có:
Vậy số oxi hóa của chlorine ở hợp chất NaClO3 có số oxi hóa +5
Hòa tan hoàn toàn 5,6 gam kim loại M trong dung dịch HNO3 đặc nóng, dư thu được 4,33825 lít NO2 (ở đkc là sản phẩm khử duy nhất ). Kim loại M là?
nNO2 = 4,33825 : 24,79 = 0,175 mol
Quá trình nhường nhận electron
M0 → M+n + ne
→
N+5 + 1e → N+4
0,175 ← 0,175
Áp dụng định luật bảo toàn e ta có:
= 0,175 ⇔ 5,6n = 0,175M ⇔ 32n = M
Lập bảng xét ta được:
| n | 1 | 2 | 3 |
| M | 32 (Loại) | 64 (Cu) | 96 (Loại) |
Vậy kim loại cần tìm là Cu
Thực hiện các phản ứng hóa học sau:
(a) S + O2 ![]() SO2
SO2
(b) Hg + S → HgS
(c) H2 + S ![]() H2S
H2S
(d) S + 3F2 ![]() SF6
SF6
Số phản ứng sulfur đóng vai trò chất oxi hóa là
(a) S0 + O2 S+4O2
(b) 2Al + 3S0 → Al2S-23
(c) H2 + S0 H2S-2
(d) S0 + 3F2 S+6F6
Sulfur đóng vai trò chất oxi hóa trong phản ứng (b) và (c) vì có số oxi hóa giảm từ 0 xuống -2.
Trong C2H4 có những loại liên kết nào?
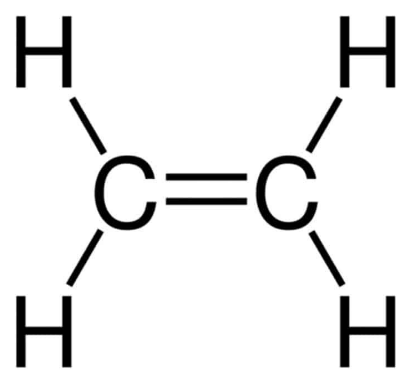
Trong phân tử C2H4, có 4 liên đơn kết C – H và 1 liên kết đôi C = C.
Cho dữ liệu sau: 2ZnS (rắn) + 3O2 (khí) → 2ZnO (rắn) + 2SO2 (khí)
∆fHo298 của ZnS = -205,6 kJ.
∆fHo298 của ZnO = -348,3 kJ
∆fHo298 của SO2 = -296,8 kJ.
Tính ∆rHo298 của phản ứng?
2ZnS (rắn) + 3O2 (khí) → 2ZnO (rắn) + 2SO2 (khí)
= 2×(-348,3) + 2×(-296,8) – 2×(-205,6) – 3×0 = -879 kJ
Cho các phản ứng dưới đây:
(1) Cracking alkane.
(2) Các phản ứng trùng hợp.
(3) Phản ứng oxi hóa.
(4) Phản ứng nhiệt nhôm.
(5) Phản ứng trung hòa.
Số phản ứng tỏa nhiệt là:
(1) Cracking alkane là phản ứng thu nhiệt
(2) Các phản ứng trùng hợp là phản ứng tỏa nhiệt
(3) Phản ứng oxi hóa là phản ứng tỏa nhiệt
(4) Phản ứng nhiệt nhôm là phản ứng tỏa nhiệt
(5) Phản ứng trung hòa là phản ứng tỏa nhiệt
Số phản ứng tỏa nhiệt là: 4
Công thức tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết của phản ứng: H2 (g) + Cl2(g) → 2HCl (g)
Phản ứng:
H-H (g) + Cl-Cl(g) → 2H-Cl (g)
Biến thiên enthalpy chuẩn của phản ứng là
Trong phản ứng 2KMnO4 + 6KI + 4H2O → 2MnO2 + 3I2 + 8KOH, ion bị oxi hóa là:
Trong phản ứng:
2KMnO4 + 6KI + 4H2O → 2MnO2 + 3I2 + 8KOH, ion bị oxi hóa là I-, số oxi hóa của ion này tăng từ -1 lên 0 trong đơn chất I2.
