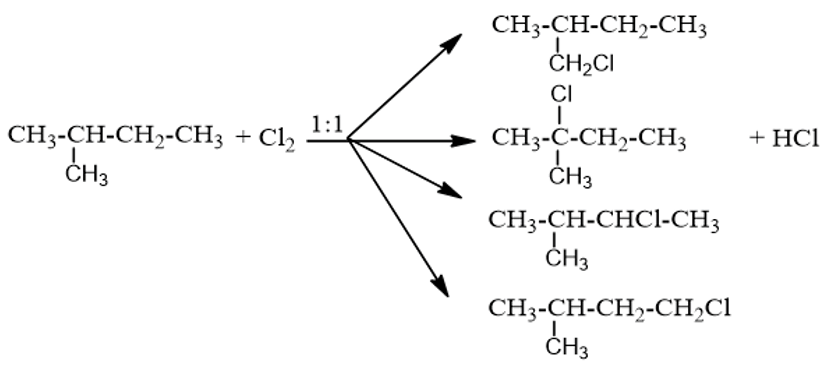
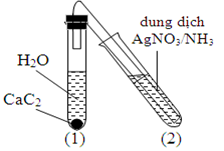
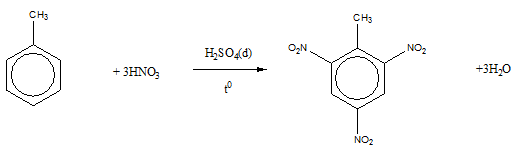Đốt cháy hoàn toàn một hydrocarbon A thu được số mol H2O bằng 1,5 lần số mol CO2. Xác định công thức A là
Theo đề bài ta có
nH2O : nCO2 = 1,5 : 1
Đặt x là số mol của CO2 ⇒ nCO2 = 1,5x
⇒ nalkane = nH2O - nCO2 = 1,5x - x = 0,5x
⇒ Công thức cảu alkane là C2H6