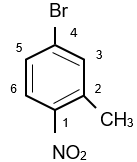
8 gam một alkyne X có thể làm mất màu tối đa 200 ml dung dịch Br2 2M. Công thức phân tử của X là
nBr2 = 0,4 mol
Gọi công thức phân tử của alkyne X là CnH2n – 2 (n ≥ 2).
X có thể làm mất màu tối đa dung dịch Br2 nên:
CnH2n – 2 + 2Br2 → CnH2n – 2Br4
mol: 0,2 ← 0,4
Vậy alkyne là C3H4.