Tiến hành thí nghiệm nhỏ 1,5 mL nước bromine vào ống nghiệm đựng 1,5 mL hexane, chiếu sáng và lắc đều. Hiện tượng quan sát được là
Do xảy ra phản ứng thế của hexane với bromine nên màu của nước bromine bị mất.
Tiến hành thí nghiệm nhỏ 1,5 mL nước bromine vào ống nghiệm đựng 1,5 mL hexane, chiếu sáng và lắc đều. Hiện tượng quan sát được là
Do xảy ra phản ứng thế của hexane với bromine nên màu của nước bromine bị mất.
Cho propyne (C3H4) tác dụng với dung dịch AgNO3 trong NH3 dư thu được 11,76 gam kết tủa màu vàng nhạt. Khối lượng propyne đã phản ứng là
Kết tủa thu được là AgC≡C-CH3 ⇒ n↓ = 0,08 (mol)
Phương trình hóa học:
CH≡C–CH3 + AgNO3 + NH3 → AgC≡C–CH3↓ + NH4NO3
Mol: 0,08 ← 0,08
⇒ m propyne = 0,08.40 = 3,2 (gam)
Đốt cháy hoàn toàn x mol hỗn hợp A gồm benzene, toluene, ethylbenzene thu được 0,15 mol CO2 và 0,12 mol H2O. Tìm x?
Ta có benzene, toluene, ethylbenzene có công thức chung là CnH2n-6 (n 6)
Phản ứng đốt cháy:
CnH2n-6 + O2
nCO2 + (n - 3) H2O
x nx (n - 3)x
Ta có hệ phương trình:
Chất nào sau đây cộng H2 dư (Ni, to) tạo thành butane?
CH3-CH2-CH=CH2 but -1- ene công H2 dư (Ni, to) tạo thành butane
Cho 2,205 gam một alkene Y phản ứng vừa đủ với 70 ml dung dịch Br2 0,75 M. Công thức phân tử của Y là
nBr2 = 0,0525 (mol)
Gọi công thức phân tử của alkene là CnH2n-2 (n ≥ 2). Ta có phương trình phản ứng:
CnH2n-2 + Br2 → CnH2n-2Br2
Mol: 0,0525 ← 0,0525
⇒ Y là C3H6.
Để sản xuất 22,311 lít acetylene (đkc) cần dùng m gam calcium carbide với hiệu suất phản ứng 100%. Giá trị của m là
nC2H2 = 0,9 (mol)
Phương trình phản ứng:
CaC2 + 2H2O → C2H2 + Ca(OH)2
mol: 0,9 ← 0,9
⇒ m = 0,9.64 = 57,6 (gam)
Cho 1 lít C6H6 (d = 0,8g/ml) tác dụng với 112 lít Cl2 (đktc) (xúc tác FeCl3) thu được 450 g chlorobenzene. Hiệu suất phản ứng điều chế chlorobenzene là
C6H6 + Cl2 C6H5Cl + HCl
Giả sử hiệu suất phản ứng là 100%.
Dựa vào phương trình ta thấy:
nCl2 = 5 mol < nC6H6 = 10,26 mol Hiệu suất tính theo Cl2
Theo phương trình phản ứng:
nC6H6Cl = nCl2 = 5 mol
Chất nào sau đây trong phân tử có liên kết ba?
Chất trong phân tử có liên kết ba là C2H2 (CH≡CH).
Đốt cháy hoàn toàn 2,479 lít hydrocarbon X thu được 7,437 lít CO2 (các thể tích khí đo ở đkc). X tác dụng với dung dịch AgNO3 trong NH3 sinh ra kết tủa màu vàng. Công thức cấu tạo của X là
nX = 0,1 (mol); nCO2 = 0,3 (mol)
X tác dụng với dung dịch AgNO3 trong NH3 sinh ra kết tủa màu vàng ⇒ X là alkyne.
Gọi công thức phân tử của X là CnH2n-2 (n ≥ 2).
Phương trình hóa học:
CnH2n-2 + O2
nCO2 + (n – 1)H2O
mol: 0,1 → 0,1n
⇒ 0,1n = 0,3
⇒ n = 3
Vậy X là C3H4, công thức cấu tạo của X là CH3-C≡CH.
Cho CH2=CH–CH3 cộng Br2 trong dung dịch thu được sản phẩm nào sau đây?
Phương trình phản ứng:
CH2=CH–CH3 + Br2 → CH2Br–CHBr –CH3.
Nhận định nào sau đây về cấu tạo của phân tử benzene không đúng?
Các góc liên kết đều bằng 120o
Cho phản ứng: C2H2 + H2O ![]() X
X
X là chất nào dưới đây
C2H2 + H2O [CH2=CHOH] → CH3CHO.
Chất nào sau đây tham gia phản ứng trùng hợp tạo polymer?
Ethylene tham gia phản ứng trùng hợp tạo thành polyethylene (PE):
nCH2=CH2 (-CH2–CH2-)n
Cho hỗn hợp A gồm các hơi và khí: 0,1 mol benzene; 0,2 mol toluene; 0,3 mol styrene và 1,4 mol hydrogen vào một bình kín, có chất xúc tác Ni. Đun nóng bình kín một thời gian, thu được hỗn hợp B gồm các chất cyclohexane, methylcyclohexane, ethylcyclohexane, benzene, toluene, ethylbenzene và hydrogen. Đốt cháy hoàn toàn lượng hỗn hợp B trên rồi cho hấp thụ hết sản phẩm cháy vào bình đựng dung dịch nước vôi trong dư. Độ tăng khối lượng bình đựng nước vôi là
Ta thấy rằng khi đốt hỗn hợp khí B cũng như đốt hỗn hợp khí A.
Vì thế, khi đốt ta có:
nCO2 = nC6H6 + 2nC7H8 + nC8H8 = 4,4 mol
mCO2 = 4,4.44 = 193,6 gam
nH2O = 3nC6H6 + 4nC7H8 + 4nC8H8 + nH2 = 3,7 mol
mH2O = 3,7.18 = 66,6 gam
Vậy độ tăng khối lượng của bình là
m = mCO2 + mH2O = 193,6 + 66,6 = 260,2 gam
Dãy đồng đẳng của alkyne có công thức chung là
Dãy đồng đẳng của alkyne có công thức chung là CnH2n – 2 (n ≥ 2).
Số đồng phân cấu tạo alkene của C4H8 là
Các đồng phân cấu tạo là:
CH2=CH–CH2–CH3;
CH3–CH=CH–CH3 (cis – trans);
CH2=C(CH3)–CH3.
Chất nào sau đây làm mất màu dung dịch bromine?
But-1-ene có liên kết đôi trong phân tử ⇒ làm mất màu dung dịch bromine.
Phát biểu nào sau đây về quá trình sản xuất các hydrocarbon trong công nghiệp là không đúng?
Phản ứng trimer hoá acetylene không được sử dụng để sản xuất các hydrocarbon trong công nghiệp.
Thực hiện thí nghiệm như hình vẽ dưới đây:
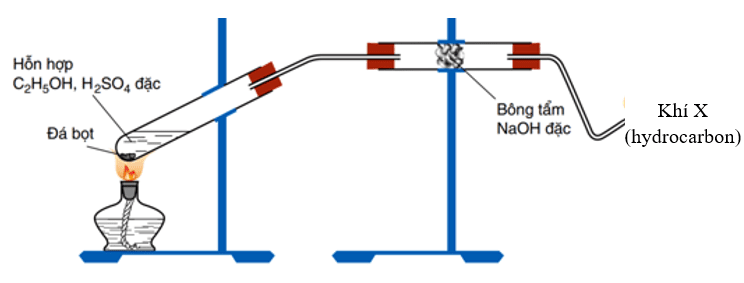
Phát biểu nào sau đây sai?
Khí X là C2H4:
C2H5OH C2H4 + H2O
Sản phẩm chính của phản ứng cộng HX (X là OH, Cl, Br,…) vào alkene bất đối xứng tuân theo quy tắc nào sau đây?
Sản phẩm chính của phản ứng cộng HX (X là OH, Cl, Br,…) vào alkene bất đối xứng tuân theo quy tắc Markovnikov.
Cho các chất sau: (1) 2-methylbutane; (2) 2-methylpentane; (3) 3-methylpentane; (4) 2,2-dimethylbutane và (5) benzene.
Trong số các chất này, có bao nhiêu chất có thể là sản phẩm reforming hexane?
Sản phẩm reforming là các mạch hydrocarbon mạch phân nhánh hoặc hydrocarbon mạch vòng nhưng không thay đổi số nguyên tử carbon trong phân tử.
⇒ Các chất có thể là sản phẩm reforming hexane: (2), (3), (4), (5).
Chất nào sau đây khi tác dụng với hỗn hợp HNO3 và H2SO4 đặc nóng tạo một sản phẩm mononitro hóa duy nhất?
C6H6 tác dụng với hỗn hợp HNO3 và H2SO4 đặc nóng tạo một sản phẩm mononitro hóa duy nhất:
C6H6 + HNO3 C6H5NO2 + H2O.
Đốt cháy hoàn toàn 4,958 lít khí C3H6 (ở đkc). Sau phản ứng hoàn toàn thu được bao nhiêu gam CO2?
nC3H6 = 0,2 (mol)
Phương trình phản ứng:
C3H6 + 9/2O2 3CO2 + 3H2O
mol: 0,2 → 0,6
⇒ mCO2 = 0,6.44 = 26,4 (gam)
Khí đốt hoá lỏng (Liquified Petroleum Gas, viết tắt là LPG) hay còn được gọi là gas, là hỗn hợp khí chủ yếu gồm propane (C3H8) và butane (C4H10) đã được hóa lỏng. Một loại gas dân dụng chứa khí hoá lỏng có tỉ lệ mol propane : butane là 40 : 60. Đốt cháy 1 lít khí gas này (ở 25°C, 1 bar) thì tỏa ra một lượng nhiệt bằng bao nhiêu? Biết khi đốt cháy 1 mol mỗi chất propane và butane tỏa ra lượng nhiệt tương ứng 2220 kJ và 2875 kJ.
Lượng nhiệt sinh ra khi đốt 1l khí gas là:
0,0161.2220 + 0,0242.2875 = 105,317 kJ
Chất nào sau đây tác dụng với dung dịch KMnO4 ở điều kiện thường?
Các alkene tác dụng được với dung dịch KMnO4 ở điều kiện thường:
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2↓ + 2KOH
Một hydrocarbon X mạch hở trong phân tử có phần trăm khối lượng carbon bằng 85,714%. Trên phổ khối lượng của X có peak ion phân tử ứng với giá trị m/z = 42. Công thức phù hợp với X là
Gọi công thức của X là CxHy
Phần trăm khối lượng của H trong X là: 100% - 85,714% = 14,286%
Công thức thực nghiệm của X là CH2.
M = 42 ⇒ (CH2)n = 42 hay 14n = 42 ⇒ n = 3.
Công thức phân tử của X là C3H6.
Vì X mạch hở, công thức phân tử dạng CnH2n chứng tỏ X là alkene.
Công thức cấu tạo phù hợp với X là CH2=CHCH3.
Nhận xét nào sau đây không đúng?
Styrene có công thức C6H5CH=CH2, có 1 liên kết đôi ngoài vòng benzene kém bền nên tham gia phản ứng cộng dễ hơn phản ứng thế.
Hợp chất nào sau đây không tồn tại?
Hợp chất không tồn tại là ![]() vì nguyên tử C sai hóa trị.
vì nguyên tử C sai hóa trị.
Cracking V lít n-butane (đkc) thu được hỗn hợp A gồm H2, CH4, C2H4, C2H6, C3H6, C4H8 và một phần butane chưa bị cracking. Đốt cháy hoàn toàn A thu được 9 gam H2O và 17,6 gam CO2. Giá trị của V là
Đốt cháy hỗn hợp A cũng là đốt cháy butane ban đầu.
nCO2 = 0,4 (mol); nH2O = 0,5 (mol)
⇒ nbutane = 0,5 – 0,4 = 0,1 (mol)
⇒ Vbutane = 0,1.24,79 = 2,479 (lít)
Chất nào sau đây có đồng phân hình học?
Các chất có đồng phân hình học khi có liên kết đôi và mỗi nguyên tử carbon ở liên kết đôi, liên kết với các nguyên tử/ nhóm nguyên tử khác nhau.
⇒ Chất có đồng phân hình học là: CH3–CH2–CH=CH–CH3.
Khí methane có lẫn CO2 và SO2. Có thể sử dụng hóa chất nào sau đây để loại bỏ CO2 và SO2?
- Chất dùng để làm sạch methane là dung dịch NaOH dư vì:
2NaOH + CO2 → Na2CO3 + H2O
2NaOH + SO2 → Na2SO3 + H2O
Khí methane không phản ứng, bay ra khỏi dung dịch.
Số alkane là chất khí ở điều kiện thường là
Ở điều kiện thường, methane, ethane, propane và butane là các chất khí, các alkane có số nguyên tử carbon nhiều hơn (trừ neopentane) là chất lỏng hoặc chất rắn.
Trong công thức cấu tạo của chất dưới đây, hai nguyên tử chlorine nằm ở vị trí nào trên vòng benzene?
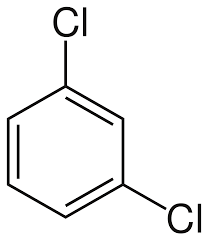
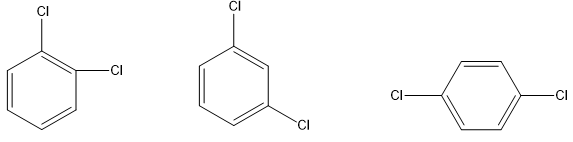
o-dichlorobenzene m-dichlorobenzene p-dichlorobenzene
Cho vài mẩu nhỏ calcium carbide vào ống nghiệm đã đựng 1 ml nước. Dẫn khí sinh ra lần lượt vào hai ống nghiệm đựng hai dung dịch sau: dung dịch bromine, dung dịch AgNO3 trong NH3. Hiện tượng quan sát ở hai ống nghiệm trên lần lượt là
Hiện tượng quan sát ở hai ống nghiệm trên lần lượt là nhạt màu và có kết tủa vàng:
Phương trình phản ứng:
CaC2 + 2H2O → C2H2 + 2Ca(OH)2
C2H2 + 2Br2 → C2H2Br4
HC≡CH + 2AgNO3 + 2NH3 → Ag–C≡C–Ag↓ (vàng) + 2NH4NO3
Hợp chất hữu cơ X có tên gọi là: 2-chloro-3-methylpentane. Công thức cấu tạo của X là:
Tên gọi của X: 2-chloro-3-methylpentane
⇒ Mạch chính gồm 5 C; đánh số gần Cl nhất:
(1)CH3–(2)CH(Cl)–(3)CH(CH3)–(4)CH2–(5)CH3.
Để khử hoàn toàn 100 ml dung dịch KMnO4 0,1 M tạo thành chất rắn màu nâu đen cần V lít khí C2H4 (ở đkc). Giá trị tối thiểu của V là:
nKMnO4 = 0,01 (mol)
3CH2=CH2 + 2KMnO4 +4H2O → 3C2H4(OH)2 + 2KOH + 2MnO2
mol: 0,015 ← 0,01
⇒ VC2H4 = 0,015.24,79 ≈ 0,3719 (lít)
Cho butane phản ứng với chlorine thu được sản phẩm chính là
Butane phản ứng với chlorine thu được sản phẩm chính là 2-chlorobutane vì ở trường hợp này Cl thế vị trí của nguyên tử H ở C2 là carbon bậc cao hơn.
Chất nào sau đây là đồng phân của CH≡C-CH2-CH3?
Đồng phân của CH≡C-CH2-CH3 là
CH3-C≡C-CH3 có cùng công thức phân tử C4H6
Alkane có chứa 8 nguyên tử hydrogen trong phân tử là
Alkane có công thức chung là CnH2n+2 (n ≥ 1).
Alkane có chứa 8 nguyên tử hydrogen trong phân tử ⇒ n + 2 = 8 ⇒ n = 3.
Vậy alkane là C3H8.
Công thức phân tử của ethylbenzene là
Ethylbenzene có công thức cấu tạo là:
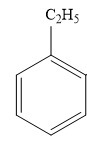
⇒ Công thức phân tử của ethylbenzene là: C8H10.
