Cho toluene tác dụng với dung dịch KMnO4 đun nóng thu được sản phẩm là:
Phương trình phản ứng:
C6H5-CH3 + 2KMnO4 C6H5COOK + 2MnO2 + KOH + H2O.
Cho toluene tác dụng với dung dịch KMnO4 đun nóng thu được sản phẩm là:
Phương trình phản ứng:
C6H5-CH3 + 2KMnO4 C6H5COOK + 2MnO2 + KOH + H2O.
Các arene thường có chỉ số octane cao nên được pha trộn vào xăng để nâng cao khả năng chống kích nổ của xăng, như toluene và xylene thường chiếm tới 25% xăng theo thể tích. Tỉ lệ này với benzene được EPA (The U.S. Environmental Protection Agency – Cơ Quan Bảo vệ môi trường Hoa Kì) quy định phải giới hạn ở mức không quá 1% vì chúng là chất có khả năng gây ung thư.
Giả sử xăng có khối lượng riêng là 0,88 g/cm3 thì trong 88 tấn xăng có pha trộn không quá bao nhiêu m3 benzene?
Thể tích của 88 tấn xăng:
⇒ Thể tích benzene tối đa trộn vào xăng:
Vbenzene = 1%×V = 1%×100 = 1 (m3)
But-1-ene có công thức cấu tạo là
But-1-ene có công thức cấu tạo là CH2=CH-CH2-CH3.
Để phân biệt styrene và phenylacetylene chỉ cần dùng chất nào sau đây?
Phenylacetylene có công thức cấu tạo:
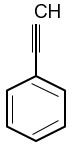
Phenylacetylene phản ứng được với dung dịch AgNO3/NH3 tạo ra kết tủa.
Một hỗn hợp khí gồm 1 alkane và 1 alkene có cùng số nguyên tử C trong phân tử và có cùng số mol. Lấy m gam hỗn hợp này thì làm mất màu vừa đủ 80 gam dung dịch 20% Br2. Đốt cháy hoàn toàn m gam hỗn hợp đó thu được 0,6 mol CO2. Alkane và alkene đó có công thức phân tử là:
nBr2 = 0,1 (mol)
Trong hỗn hợp chỉ có alkene làm mất màu dung dịch bromine:
⇒ nalkene = 0,1 (mol) ⇒ nalkane = 0,1 (mol)
⇒ nhỗn hợp = 0,2 (mol)
Gọi số carbon trong phân tử alkane cũng như alkene là m (m ≥ 2), ta có:
0,1.m + 0,1.m = 0,6
⇒ m = 3
Vậy alkane và alkene lần lượt là: C3H8 và C3H6.
Phương pháp điều chế ethylene trong phòng thí nghiệm là
Phương pháp điều chế ethylene trong phòng thí nghiệm là đun C2H5OH với H2SO4 đặc ở 170oC:
C2H5OH CO2 + H2O
Công thức cấu tạo thu gọn của styrene là:
Công thức cấu tạo thu gọn của styrene là: C6H5-CH=CH2.
Alkane có khả năng tham gia phản ứng nào sau đây?
Alkane có khả năng tham gia phản ứng thế với halogen.
Hỗn hợp X gồm alkene Y và H2. Tỉ khối hơi của X so với H2 là 7,67. Dẫn X qua Ni nung nóng đến phản ứng hoàn toàn thu được hỗn hợp Z có tỉ khối so với H2 là 11,50. Alkene Y là
Gọi công thức của alkene là CnH2n (n ≥ 2).
Nhận thấy: MY = 11,5.2 = 23 < 28
⇒ Sau phản ứng H2 còn dư, CnH2n đã phản ứng hết.
Bảo toàn khối lượng:
Chọn nX = 1,5 mol và nY = 1 mol
Ta có:
nH2 p/ư = 1,5 − 1 = 0,5 mol
⇒ nCnH2n = nH2 p/ư = 0,5 mol
Vậy ban đầu, trong X có 0,5 mol CnH2n và 1 mol H2.
Vậy công thức của alkene là C3H6.
Dãy nào sau đây chỉ gồm các chất thuộc dãy đồng đẳng của benzene?
Dãy đồng đẳng của benzene có công thức chung là: CnH2n – 6 (n ≥ 6).
⇒ Dãy chất thỏa mãn là: C7H8; C8H10.
Nếu chỉ dùng AgNO3 trong dung dịch NH3 làm thuốc thử thì phân biệt được:
Nếu chỉ dùng AgNO3 trong dung dịch NH3 làm thuốc thử thì phân biệt được: but-1-ene và propyne.
- Propyne tác dụng với AgNO3 trong dung dịch NH3 thu được kết tủa vàng.
- But-1-ene không tác dụng với AgNO3 trong dung dịch NH3 ⇒ không có hiện tượng.
Chất nào sau đây trong phân tử có liên kết đôi?
C2H4 là chất trong phân tử có liên kết đôi, vì có công thức dạng CnH2n thuộc alkene.
Nung nóng a mol hỗn hợp X gồm C2H2 và H2 trong bình kín có xúc tác thích hợp thu được hỗn hợp khí Y. Dẫn Y qua lượng dư dung dịch AgNO3 trong NH3, sau khi phản ứng hoàn toàn thu được 24 gam kết tủa và hỗn hợp khí Z. Hỗn hợp Z làm mất màu tối đa 40 gam bromine trong dung dịch và còn lại hỗn hợp khí T. Đốt cháy hoàn toàn hỗn hợp T thu được 11,7 gam nước. Giá trị của a là
Y tác dụng với AgNO3/NH3 thu được kết tủa ⇒ Y chứa C2H2 dư.
Sau khi dẫn Z qua dung dịch Br2 dư còn hỗn hợp khí T nên T chứa H2 và C2H6 ⇒ Y chứa H2 dư.
Ta có sơ đồ:
Ta có:
nC2H2(dư) = nAg2C2 = = 0,1 mol
nC2H4 = nBr2 = = 0,25 mol
Bảo toàn nguyên tố H cả quá trình:
2nC2H2(bđ) + 2nH2(bđ) = 2nC2H2(dư) + 4nC2H4 + 2nH2O
⇒ nC2H2(bđ) + nH2(bđ) = nC2H2(dư) + 2nC2H4 + nH2O
⇒ a = 0,1 + 2.0,25 + 0,65
⇒ a = 1,25 (g)
Phát biểu nào sau đây không đúng?
Ở điều kiện thường, benzene không làm mất màu dung dịch bromine.
Cho 4 chất: methane, ethane, propane và n-butane. Số lượng chất tạo được một sản phẩm thế monochloro duy nhất là:
Chỉ có methane và ethane chỉ cho 1 sản phẩm thế monochloro duy nhất, 2 chất còn lại đều cho 2 sản phẩm.
Cho các alkene sau:
a) CH2=CH-CH2-CH3
b) (CH3)2C=C(CH3)2
c) CH3-CH2-CH=CH-CH3
d) CH3-CH2-CH=CH-CH2-CH3
e) CH2=C(CH3)-CH2-CH2-CH3
Số alkene có đồng phân hình học là
Hai phân tử alkene có đồng phân hình học là:
(c) CH3 -CH2-CH=CH-CH3;
(d) CH3-CH2-CH=CH-CH2-CH3
Ta thấy: trong phân tử hai alkene trên, nguyên tử C trong liên kết đôi liên kết với hai nhóm thế khác nhau nên chúng có đồng phân hình học.
Cho 3,25 gam acetylene vào lượng dư dung dịch AgNO3 trong NH3, sau khi phản ứng kết thúc thu được m gam kết tủa. Giá trị của m là
nC2H2 = 0,125 (mol)
C2H2 + 2AgNO3 + NH3 → Ag-C≡C-Ag↓ + 2NH4NO3
mol: 0,125 → 0,125
⇒ m↓ = mAg-C≡C-Ag = 0,125.240 = 30 (gam).
Hydrogen hóa hoàn toàn 12,64 gam hỗn hợp ethylbezene và styrene cần 9,916 lít H2 (đkc). Thành phần phần trăm về khối lượng của ethylbenzene trong hỗn hợp là:
nH2 = 0,4 mol
Gọi số mol của ethylbenzen và styrene trong X lần lượt là x và y (mol).
mX = mC8H10 + mC8H8 = 106x + 104y = 12,64 (1)
Phản ứng hydrogen hóa:
C8H10 + 3H2 ⟶ C8H16
x ⟶ 3x mol
C8H8 + 4H2 ⟶ C8H16
y ⟶ 4y mol
Theo phương trình hóa học:
nH2 = 3x + 4y = 0,4 (2)
Từ (1) và (2) x = 0,08 và y = 0,04.
Alkane nào sau đây có 2 đồng phân?
Alkane có 2 đồng phân là: C3H8.
CH3-CH2-CH2-CH3;
CH3-CH(CH3)-CH3.
Cho các hydrocaron sau: CH4, C2H6, C3H6, C3H4, C4H10, C5H10. Có bao nhiêu hydrocarbon thuộc dãy đồng đẳng của alkane?
Các alkane có công thức chung là CnH2n+2.
⇒ Các chất thuộc loại alkane là CH4, C2H6, C4H10.
Benzene phản ứng với bromine khan khi có mặt xúc tác bột sắt là phản ứng thế.
Số nguyên tử hydrogen trong phân tử propyne là
Propyne có công thức là C3H4.
⇒ Số nguyên tử hydrogen trong phân tử propyne là 4.
Trùng hợp 60 kg propylene thu được m kg polymer, biết hiệu suất phản ứng đạt 70%. Giá trị của m là
nCH2=CH-CH3 → (-CH2-CH(CH3)-)n
Theo lí thuyết: mpolymer = mpropylene = 60 kg
Phát biểu nào sau đây là không đúng?
Các alkene và alkyne đều nhẹ hơn nước, không tan hoặc rất ít tan trong nước.
Cho phản ứng: CH2=CH2 + H2O ![]() A. Chất A là
A. Chất A là
Chất A là C2H5OH:
CH2=CH2 + H2O C2H5OH
Tên gọi của hợp chất sau theo danh pháp thay thế là
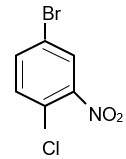
Đánh số trên vòng sao cho tổng vị trí trên vòng là nhỏ nhất:
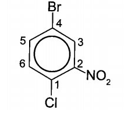
4-bromo-1-chloro-2-nitrobenzene.
Gốc C6H5-CH2- và gốc C6H5- có tên gọi là:
C6H5-CH2-: Benzyl
C6H5- có tên gọi là: phenyl.
Phân tử sau đây có bao nhiêu nguyên tử carbon bậc I?
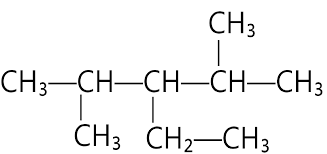
Bậc của một nguyên tử carbon trong phân tử alkane được xác định bằng số nguyên tử carbon liên kết trực tiếp với nguyên tử carbon đó.
Vậy ta có bậc của các nguyên tử C trong phân tử trên là:
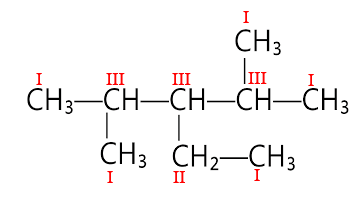
⇒ Phân tử có 4 nguyên tử carbon bậc 1.
Phương pháp nào sau đây có thể được thực hiện để góp phần hạn chế ô nhiễm môi trường do các phương tiện giao thông gây ra?
Phương pháp có thể được thực hiện để góp phần hạn chế ô nhiễm môi trường do các phương tiện giao thông gây ra là: sử dụng phương tiện chạy bằng điện hoặc nhiên liệu xanh.
Để nhận biết hex–1–yne và hex–2–yne chứa trong hai lọ giống nhau ta sử dụng hóa chất nào sau đây?
hex – 1 – yne (CH3[CH2]3C ≡ CH)
và hex – 2 – yne (CH3C ≡ C[CH2]2CH3)
Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Sử dụng dung dịch AgNO3/ NH3 làm thuốc thử.
Nếu xuất hiện kết tủa vàng → hex – 1 – yne. Phương trình hoá học:
CH3[CH2]3C ≡ CH + Ag(NH3)2OH → CH3[CH2]3C ≡ CAg + 2NH3 + H2O.
Không có hiện tượng gì xuất hiện → hex – 2 – yne.
Biogas là một loại khí sinh học, được sản xuất bằng cách ủ kín các chất thải hữu cơ trong chăn nuôi, sinh hoạt. Biogas được dùng để đun nấu, chạy máy phát điện sinh hoạt gia đình. Thành phần chính của biogas là
Biogas hay khí sinh học là một hỗn hợp khí (chủ yếu là methane, chiếm hơn 60%) được sinh ra từ quá trình phân huỷ kị khí của các phụ phẩm nông nghiệp (chất thải của gia súc, gia cầm, rơm, rạ,...), rác thải hữu cơ,...
Phần trăm khối lượng carbon trong phân tử alkyne Y bằng 88,24%. Công thức phân tử của Y là:
Gọi công thức phân tử của alkyne Y là CnH2n–2 (n ≥ 2):
Phần trăm khối lượng carbon trong phân tử alkyne Y bằng 88,24% nên:
⇒ Công thức phân tử của Y là C5H8.
Methane tác dụng với Cl2 (tỉ lệ mol 1:1) khi chiếu sáng thu được sản phẩm hữu cơ nào sau đây?
Do tỉ lệ mol phản ứng là 1 : 1 nên:
CH4 + Cl2 → CH3Cl + HCl
Dẫn từ từ 0,3 mol hỗn hợp X gồm 2 alkene là C3H6 và C4H8 lội chậm qua bình đựng dung dịch KMnO4 1M. Thể tích dung dịch thuốc tím bị mất màu là:
Gọi công thức chung của 2 alkene là CnH2n. Ta có phương trình phản ứng:
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2KOH + 2MnO2↓
mol: 0,3 → 0,2
Thể tích dung dịch thuốc tím bị mất màu là:
Cho các chất sau: C2H6 (a), C5H12 (b), C4H10 (c), C3H8 (d). Dãy các chất sắp xếp theo nhiệt độ sôi tăng dần là:
Nhận thấy các chất đều thuộc dãy đồng đẳng của alkane.
Khi số carbon tăng, tương tác van der Waals giữa các phân tử alkane tăng, dẫn đến nhiệt độ sôi và nhiệt độ nóng chảy của các alkane nhìn chung cũng tăng.
⇒ Dãy các chất sắp xếp theo nhiệt độ sôi tăng dần là: (a), (d), (c), (b).
Đốt cháy hoàn toàn 0,3 mol hỗn hợp 2 alkane thu được 18,9 gam H2O. Cho sản phẩm cháy vào dung dịch Ca(OH)2 dư thì khối lượng kết tủa thu được là:
Ta có: nH2O = 1,05 mol
nAlkane = nH2O - nCO2
⇒ nCO2 = nH2O - nAlkane = 1,05 - 0,3 = 0,75 mol
Áp dụng bảo toàn nguyên tố C:
nCaCO3 = nCO2 = 0,75 mol
⇒ mCaCO3 = 0,75.100 = 75 gam
Cho sơ đồ phản ứng sau: CaCO3 ![]() CaO
CaO ![]() CaC2
CaC2 ![]() C2H2. Từ 100 gam CaCO3, hãy cho biết cuối quá trình thu được bao nhiêu lít C2H2 (đkc).
C2H2. Từ 100 gam CaCO3, hãy cho biết cuối quá trình thu được bao nhiêu lít C2H2 (đkc).
nCaCO3 = 1 (mol)
CaCO3 CaO
CaC2
C2H2
Thể tích C2H2 thu được cuối quá trình:
VC2H2 = nC2H2.24,79 = (1.100%.80%.100%) .24,79 = 19,832 (lít)
Chất nào sau đây có khả năng trùng hợp tạo polymer?
CH2=CH2 có khả năng trùng hợp tạo polymer:
nCH2=CH2 (-CH2–CH2-)n
Ở điều kiện thường, chất nào sau đây ở trạng thái khí?
Nhận thấy các chất đều là alkane.
Ở điều kiện thường, methane, ethane, propane và butane là các chất khí, các alkane có số nguyên tử carbon nhiều hơn (trừ neopentane) là chất lỏng hoặc chất rắn.
Cho hỗn hợp X gồm ethylene và H2 có tỉ khối so với H2 bằng 4,25. Dẫn X qua bột nickel nung nóng (hiệu suất phản ứng 80%) thu được hỗn hợp Y. Tỉ khối của Y so với H2 là (các thể tích đo ở cùng điều kiện) là:
Giả sử lấy 1 mol hỗn hợp X. Gọi nC2H4 = x mol; nH2 = y mol
⇒ x + y = 1 (1)
Từ (1) và (2) ⇒ x = 0,25 mol; y = 0,75 mol
Phương trình phản ứng:
C2H4 + H2 C2H6
⇒ Hiệu suất phản ứng tính theo C2H4.
⇒ nC2H4 p/ư = nhh khí giảm = 0,25.0,8 = 0,2 mol
⇒ nY = 1 – 0,2 = 0,8 mol
⇒ dY/H2 = 5,3125
