Alkyne X có công thức là CH≡C-CH(CH3)-CH3, có tên thay thế là:
Đánh số các nguyên tử carbon từ đầu gần liên kết 3 hơn:
(1)CH≡(2)C-(3)CH(CH3)-(4)CH3
⇒ Tên gọi của alkyne là 3-methylbut-1-yne.
Alkyne X có công thức là CH≡C-CH(CH3)-CH3, có tên thay thế là:
Đánh số các nguyên tử carbon từ đầu gần liên kết 3 hơn:
(1)CH≡(2)C-(3)CH(CH3)-(4)CH3
⇒ Tên gọi của alkyne là 3-methylbut-1-yne.
Gọi tên arene sau theo danh pháp thay thế
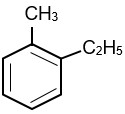
Đánh số trên vòng benzene sao cho tổng chỉ số các nhánh là nhỏ nhất

1-ethyl-2-methylbenzene
Cho butane qua xúc tác (ở nhiệt độ cao) thu được hỗn hợp X gồm C4H10, C4H8, C4H6 và H2. Tỉ khối của X so với butane là 0,4. Nếu cho 0,6 mol X tác dụng với dung dịch nước bromine dư thì số mol bromine tối đa phản ứng là
MX = 0,4.58 = 23,2 ⇒ mX = 0,6.23,2 = 13,92 g
Bảo toàn khối lượng ta có mX = mC4H10 = 13,92 (g)
Do đó 0,6 mol X được tạo từ 0,24 mol C4H10.
nX – nC4H10 = nH2 = 0,6 – 0,24 = 0,36 mol
Khi X tác dụng với dung dịc Br2 thì:
nBr2 = nH2 = 0,36 mol
Chất nào sau đây làm mất màu dung dịch KMnO4 khi đun nóng?
Khi đun nóng toluene với dung dịch KMnO4 thì xảy ra hiện tượng dung dịch KMnO4 bị mất màu.
C6H5CH3 + 2KMnO4 → C6H5COOK + KOH + 2MnO2 + H2O
Hỗn hợp khí X gồm H2 và C3H6 có tỉ khối so với H2 là 9. Hỗn hợp X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với H2 là 11,25. Hiệu suất của phản ứng hydrogen hóa là
Theo bài ra ta có:
MX = 9.2 = 18; MY = 11,25.2 = 22,5
Gọi số mol của C3H6 và H2 trong hỗn hợp ban đầu là x và y. Chọn 1 mol hỗn hợp ta có hệ:
Phương trình hóa học:
C3H6 + H2 → C3H8
mol: a a a
Bảo toàn khối lượng ta có: mX = mY
⇒ 18.1 = 22,5.nY ⇒ nY = 0,8 mol
⇒ a = 1 – 0,8 = 0,2 mol
Cho benzene tác dụng với lượng dư HNO3 đặc có xúc tác H2SO4 đặc để điều chế nitrobenzene. Khối lượng benzene cần dùng để điều chế được 12,3 kg nitrobenzene là (Giả sử hiệu suất phản ứng là 100%)
nnitrobenzene = 100 (mol)
Phương trình hóa học:
C6H6 + HONO2 → C6H5NO2 + H2O
mol: 100 ← 100
Khối lượng benzene cần dùng điều chế là:
mbenzene = 100.78 = 7800 (gam) = 7,8 kg
Hỗn hợp X gồm 0,1 mol C2H2; 0,15 mol C2H4; 0,2 mol C2H6 và 0,3 mol H2. Đun nóng X với bột Ni xúc tác 1 thời gian được hỗn hợp Y. Đốt cháy hoàn toàn hỗn hợp Y được số gam CO2 và H2O lần lượt là
Đốt cháy Y cũng chính là đốt cháy X.
- Bảo toàn nguyên tố C:
nCO2 = 2.nC2H2 + 2.nC2H4 + 2.nC2H6 = 2.0,1 + 2.0,15 + 2.0,2 = 0,9 mol
⇒ mCO2 = 39,6 gam
- Bảo toàn nguyên tố H:
nH2O = nC2H2 + 2.nC2H4 + 3.nC2H6 + nH2 = 1,3 mol
⇒ mH2O = 23,4 gam
Dẫn dòng khí gồm acetylene và ethylene lần lượt đi vào ống nghiệm đựng dung dịch AgNO3/NH3 ở điều kiện thường. Hiện tượng quan sát được là:
Dẫn dòng khí gồm acetylene và ethylene lần lượt đi vào ống nghiệm đựng dung dịch AgNO3/NH3 ở điều kiện thường có acetylene phản ứng tạo thành kết tủa màu vàng nhạt là AgC≡CAg. Ethylene không phản ứng thoát ra ngoài.
Phương trình phản ứng:
CH≡CH + 2AgNO3+ 2NH3 → AgC≡CAg + 2NH4NO3
Dẫn V lít (ở đkc) hỗn hợp X gồm acetylene và hydrogen đi qua ống sứ đựng bột nickel nung nóng, thu được khí Y. Dẫn Y vào lượng dư AgNO3 trong dung dịch NH3 thu được 12 gam kết tủa. Khí đi ra khỏi dung dịch phản ứng vừa đủ với 16 gam bromine và còn lại khí Z. Đốt cháy hoàn toàn khí Z được 2,479 lít khí CO2 (đkc) và 4,5 gam H2O. Giá trị của V bằng
Sơ đồ phản ứng:
Y tác dụng với AgNO3/NH3:
C2H2 + 2AgNO3 + 2NH3→ C2Ag2 + 2NH4NO3
mol: 0,05 ← 0,05
⇒ nC2H2 dư = 0,05 mol
Khí đi ra khỏi bình là C2H4, C2H6, H2.
⇒ nC2H4 = nBr2 phản ứng = 0,1 mol
Khí Z gồm: C2H6 và H2
Bảo toàn C: nC2H6 = .nCO2 = 0,05 mol
Bảo toàn H: nH2O = 3.nC2H6 + nH2 ⇒ nH2 = 0,25 – 3.0,05 = 0,1 mol
Bảo toàn nguyên tố C trong hỗn hợp X:
nC2H2 ban đầu = nC2H2 dư + nC2H2 p/ứ = nC2H2 dư + nC2H4 + nC2H6
⇒ nC2H2 bđ = 0,05 + 0,1 + 0,05 = 0,2 mol
nH2 bđ = nH2 p/ứ + nH2 dư = nC2H4 + 2.nC2H6 + nH2 dư = 0,3 mol
⇒ V = (0,2 + 0,3).24,79 = 11,2 (l)
Cho biết sản phẩm của phản ứng: C6H6 + Cl2 ![]()
Phương trình phản ứng:
C6H6 + 3Cl2 C6H6Cl6
Sản phẩm của phản ứng là C6H6Cl6.
Dưới tác dụng của nhiệt độ và xúc tác, butane (C4H10) thực hiện phản ứng tách tạo methane (CH4) và
Phương trình phản ứng:
C4H10 CH4 + C3H6
Cho hai hydrocarbon thơm có cùng công thức phân tử C9H12:
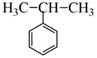 ;
; 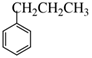
Hai hợp chất trên là:
Hai hợp chất trên là đồng phân mạch carbon.
Trong số các alkyne có công thức phân tử C5H8 có mấy chất tác dụng được với dung dịch AgNO3 trong NH3?
Chỉ các ank–1–yne mới tác dụng được với AgNO3/NH3.
Vậy trong số các alkyne có công thức phân tử C5H8 chỉ có 2 chất có thể tác dụng được với AgNO3/ NH3 là:
CH≡C–CH2–CH2–CH3
CH≡C–CH(CH3)–CH3
Chất nào sau đây không làm mất màu dung dịch nước bromine?
Methane không làm mất màu dung dịch nước bromine.
Alkane hòa tan tốt trong dung môi nào sau đây?
Alkane là phân tử không phân cực nên tan tốt trong các dung môi không phân cực.
Ví dụ: benzene.
Cho 7,437 lít hỗn hợp khí gồm ethane và ethylene qua dung dịch bromine dư thấy dung dịch mất màu và có 1,4874 lít khí thoát ra. Các thể tích khí đo ở đkc và các phản ứng xảy ra hoàn toàn. Thành phần % thể tích của ethylene là
Khí thoát ra là ethane ⇒ Vethane = 1,4874 (lít)
⇒ Vethylene = 7,437 – 1,4874 = 5,9496 (lít)
Thành phần % thể tích của ethylene:
Sản phẩm chính của phản ứng cộng hợp HCl vào propene là:
Theo quy tắc Marcovnikov thì sản phẩm chính khi cộng hợp HCl vào propene là: CH3CHClCH3.
Phát biểu nào dưới đây sai?
Khi số nguyên tử carbon tăng, tương tác van der Waals giữa các phân tử alkane tăng, dẫn đến nhiệt độ sôi và nhiệt độ nóng chảy của các alkane nói chung cũng tăng.
Dẫn hợp chất hữu cơ X (có khối lượng phân tử là 56) vào nước bromine, quan sát thấy nước bromine nhạt màu. Chất hữu cơ X có thể là
Chất X làm nhạt màu nước bromine ⇒ trong X có liên kết bội.
Lại có MX = 56 ⇒ Quan sát đáp án ta có X là CH3-CH2-CH=CH2.
Đốt cháy hoàn toàn 10,25 gam hỗn hợp gồm hai 2 chất A và B (A, B đều là đồng đẳng kế tiếp thuộc dãy của benzene) thu được 34,10 gam CO2. Công thức phân tử của A và B lần lượt là
nCO2 = 0,775
Gọi công thức chung của A và B là CnH2n – 6 (n ≥ 6):
CnH2n – 6 + (4n– 3)/2 O2 nCO2 + (n – 3) H2O
mol: ← 0,775
⇒ n = 7,75
Theo bài ra ta có: A, B đều là đồng đẳng kế tiếp thuộc dãy của benzene
⇒ A và B lần lượt là C7H8 và C8H10.
Oxi hóa ethylene bằng dung dịch KMnO4 thu được sản phẩm là:
Phương trình hóa học:
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2↓ + 2KOH
⇒ Oxi hóa ethylene bằng dung dịch KMnO4 thu được sản phẩm là: MnO2, C2H4(OH)2, KOH.
Cho các alkene: CH2=CH–CH3 (X); CH3–CH=CH–CH3 (Y); (CH3)2C=CH2 (Z). Alkene nào có đồng phân hình học?
Các alkene có đồng phân hình học khi mỗi nguyên tử carbon của liên kết đôi liên kết với hai nguyên tử, nhóm nguyên tử khác nhau.
⇒ Chỉ alkene Y có đồng phân hình học.
Công thức phân tử nào dưới đây không thể là của một arene?
Các công thức phân tử của arene là C7H8, C10H8, C8H8.
Arene có nhóm thế no, có công thức chung là CnH2n-6 (n ≥ 6) ⇒ Ứng với số C là 11, ta có công thức của arene có nhóm thế no là C11H16. Vậy một arene ứng với số C là 11, số H tối đa là 16.
Ở công thức C8H16, ta thấy số H là 18, do đó không hợp lý.
Câu nào sau đây sai?
Propyne: CH≡C–CH3
⇒ Trong propyne có 2 liên kết π và 6 liên kết σ.
Trong công nghiệp, alkane được điều chế từ:
Trong công nghiệp, alkane được khai thác, chế biến từ khí thiên nhiên, khí đồng hành, dầu mỏ
Trong các chất dưới đây, chất nào có nhiệt độ sôi thấp nhất?
Khi số nguyên tử carbon trong alkane tăng, tương tác van der Waals giữa các phân tử alkane tăng, dẫn đến nhiệt độ sôi và nhiệt độ nóng chảy của các alkane nói chung cũng tăng.
⇒ Alkane có nhiệt độ sôi thấp nhất là alkane có số carbon nhỏ nhất: methane
Cho 12,4 gam hỗn hợp X gồm CaC2 và Ca vào nước thu được 6,198 lít hỗn hợp khí Y (đkc). Cho hỗn hợp khí Y tác dụng với AgNO3 trong NH3 thì thu được bao nhiêu gam kết tủa?
Gọi nCaC2 = x mol; nCa = y mol
⇒ mhh X = 64x + 40y = 12,4 (1)
Phương trình phản ứng:
CaC2 + 2H2O → Ca(OH)2 + C2H2
mol: x → x
Ca + 2H2O → Ca(OH)2 + H2
mol: y → y
⇒ nhh Y = x + y = 0,25 (2)
Từ (1) và (2) ⇒ x = 0,1; y = 0,15
⇒ nAg2C2 = nC2H2 = 0,1 mol
⇒ mkết tủa = 24 gam
Khi cho CH3-CH3 phản ứng với khí Cl2 theo tỉ lệ mol (1:1) có chiếu sáng, thu được sản phẩm nào sau đây?
Do tỉ lệ mol phản ứng là 1 : 1 nên:
CH3-CH3 + Cl2 → CH3-CH2-Cl + HCl
Cho các chất sau: methane, ethylene, acetylene, benzene, toluene và naphthalene. số chất ở thể lỏng trong điều kiện thường là:
Thể khí: methane, ethylene, acetylene.
Thể lỏng: benzene, toluene.
Thể rắn: naphthalene.
Cho sơ đồ phản ứng:
CH≡C-CH3 + H2 (dư) ![]() C;
C;
CH≡C-CH3 + H2 ![]() T
T
X, Y lần lượt là:
Phương trình phản ứng
CH≡C-CH3 + H2 (dư) CH3CH2CH3 (X);
CH≡C-CH3 + H2 CH2=CHCH3 (Y).
Cho hydrocarbon X phản ứng với bromine (trong dung dịch) theo tỉ lệ mol 1 : 1, thu được chất hữu cơ Y (chứa 74,08% Br về khối lượng). Khi X phản ứng với HBr thì thu được hai sản phẩm hữu cơ khác nhau. Tên gọi của X là
Theo đề bài ta có:
⇒ MY = 216
Ta có: MX = M Y – 2.MBr
⇒ MX = MY – 2.MBr =216 - 160 = 56 gam/mol
Vậy X chính là C4H8
Khi X phản ứng với HBr thì thu được hai sản phẩm hữu cơ khác nhau
Vậy công thức thỏa mãn but-1-ene.
CH2=CH-CH2-CH3 + HBr → CH3-CHBr-CH2-CH3
CH2=CH-CH2-CH3 + HBr→ BrCH2-CH2-CH2-CH3
Bậc của nguyên tử carbon đánh dấu (*) trong hợp chất sau là
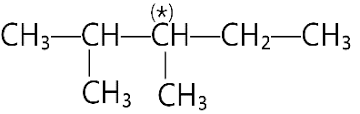
Ta có thấy nguyên tử carbon có đánh dấu (*) liên kết trực tiếp với 3 nguyên tử carbon khác.
⇒ Nguyên tử carbon (*) có bậc III.
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm methane, ethane, propane bằng oxygen không khí (trong không khí, oxygen chiếm 20% thể tích), thu được 8,6765 lít khí CO2 (ở đkc) và 9,9 gam nước. Thể tích không khí (ở đkc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là
nCO2 = 0,35 (mol); nH2O = 0,55 (mol)
Bảo toàn nguyên tố O:
2.nO2 = 2.nCO2 + nH2O
⇒ 2x = 0,35.2 + 0,55 ⇒ x = 0,625
Thể tích không khí cần dùng là nhỏ nhất ⇒ oxygen trong không khí phản ứng vừa đủ.
⇒ VO2 (đkc) = 0,625.24,79 ≈ 15,5 lít
⇒ VKK (đkc) = 5.15,5 = 77,5 lít
Anthracene là một arene đa vòng, được điều chế từ than đá. Anthracene được dùng để sản xuất thuốc nhuộm alizarin đỏ, bảo quản gỗ, làm thuốc trừ sâu, ... Anthracene có công thức cấu tạo:
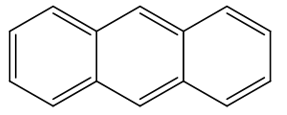
Công thức phân tử của anthracene là
Công thức phân tử của anthracene là C14H10.
Theo ước tính, trung bình mỗi ngày một con bò “ợ” vào bầu khí quyển khoảng 250 L – 300 L một chất khí có khả năng gây hiệu ứng nhà kính. Khi đó là
Các chất khí gây hiệu ứng nhà kính điển hình là CO2 và CH4.
Thức ăn của bò là các chất xơ khó tiêu nên chúng phải ợ thức ăn đã phân hủy một phần trong dạ cỏ trở lại miệng để nhai lại. Cùng với thức ăn, bò còn ợ ra khí thải được tạo ra tại ngăn dạ dày kể trên. Theo ước tính, mỗi ngày một con bò “xả” vào bầu khí quyển khoảng 250 - 300 lít methane. Khí thải từ miệng một con bò gây hại cho môi trường tương đương khí thải của một chiếc xe hơi phân khối lớn.
Chất nào sau đây thuộc dãy đồng đẳng của alkane?
Alkane là hydrocarbon mạch hở, chỉ chứa liên kết đơn trong phân tử và có công thức chung là CnH2n+2 (n ≥ 1).
⇒ Chất thuộc dãy đồng đẳng của alkane là CH3–CH3.
Chất nào trong 4 chất dưới đây có thể tham gia cả 4 phản ứng: Phản ứng cháy trong oxygen, phản ứng cộng bromine, phản ứng cộng hydrogen (xúc tác Ni, to), phản ứng thế với dung dịch AgNO3/NH3?
Để có thể tham gia cả 4 phản ứng: Phản ứng cháy trong oxygen, phản ứng cộng bromine, phản ứng cộng hydrogen (xúc tác Ni, to), phản ứng thế với dung dịch AgNO3/NH3 thì chất đó cần có liên kết ba đứng đầu mạch trong phân tử.
⇒ Chỉ có acetylene thỏa mãn.
Đun nóng hỗn hợp khí gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch bromine (dư) thì còn lại 0,4958 lít hỗn hợp khí Z (ở đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch bromine tăng là
Bảo toàn khối lượng ta có: mC2H2 + mH2 = mY = mZ + mbình tăng
⇒ 0,06.26 + 0,04.2 = mbình tăng + 0,02.0,5.32
⇒ mbình tăng = 1,32 gam
Trùng hợp ethylene, sản phẩm thu được có cấu tạo là
Phương trình phản ứng trùng hợp:
nCH2=CH2 (-CH2-CH2-)n
Cracking 4,4 gam propane được hỗn hợp X (gồm 3 hydrocarbon). Dẫn X qua nước bromine dư thấy khí thoát ra (Y) có tỉ khối so với H2 là 10,8. Hiệu suất cracking propane là
Sơ đồ phản ứng:
Gọi số mol C3H8 phản ứng là x (mol)
C3H8 CH4 + C2H4
Theo phương trình hóa học:
nCH4 = nC2H4 = nC3H8(pứ) = x (mol)
Ta có Y gồm: CH4 (x mol) và C3H8 dư ((0,1 – x) mol)
