Ở điều kiện thích hợp, alkene tác dụng với chất nào sau đây tạo thành alkane tương ứng?
Ở điều kiện thích hợp, alkene tác dụng với H2 tạo thành alkane tương ứng.
Ở điều kiện thích hợp, alkene tác dụng với chất nào sau đây tạo thành alkane tương ứng?
Ở điều kiện thích hợp, alkene tác dụng với H2 tạo thành alkane tương ứng.
Tiến hành trùng hợp 1 mol ethylene ở điều kiện thích hợp, đem sản phẩm sau trùng hợp tác dụng với dung dịch bromine dư thì lượng bromine phản ứng là 36 gam. Hiệu suất phản ứng trùng hợp và khối lượng polyethylene (PE) thu được là
nBr2 p/ứ = nethylen dư = 0,225 mol
⇒ nethylen trùng hợp = 1 – 0,225 = 0,775 mol
mPE = methylen trùng hợp = 0,775.28 = 21,7 gam.
Nhận định nào sau đây là đúng?
Nhận định đúng là: Alkene là hydrocarbon không no, mạch hở, trong phân tử có một liên kết C=C.
Công thức phân tử alkane chứa 28 nguyên tử H là
Alkane có công thức chung là CnH2n+2 (n ≥ 1).
Số H là 28 ⇒ 2n + 2 = 28 ⇒ n = 13
Vậy alkane là C13H28.
Dãy chất nào sau đây thuộc loại alkane?
Các alkane có công thức chung là CnH2n+2.
⇒ Dãy chất thuộc loại alkane là C2H6, CH4, C5H12.
Phát biểu nào sau đây không đúng?
Nhiều chất trong phân tử có vòng benzene nhưng không thuộc hydrocarbon thơm.
Ví dụ: C6H5OH, C6H5–CH2OH
Khi đốt cháy hoàn toàn alkyne, thu được
Gọi công thức chung của alkyne là CnH2n-2 (n ≥ 2)
Khi đốt cháy hoàn toàn alkyne, ta có:
CnH2n – 2 + (3n – 1)/2 O2 nCO2 + (n – 1) H2O
mol: a → an → a(n – 1)
⇒ a(n – 1) < an
⇒ nH2O < nCO2
Cho các phát biểu sau:
(a) Alkane được ứng dụng làm nhiên liệu, dung môi, dầu nhờn,...
(b) Alkene có 4 nguyên tử carbon sẽ có phân tử khối là 56 đvC.
(c) Phân tử alkyne chứa 2 liên kết π.
(d) Các alkyne đều có phản ứng với dung dịch AgNO3 trong NH3.
Số phát biểu đúng là
Phát biểu:
(a) đúng.
(b) đúng. Alkene có 4 C là C4H8 có M = 56 đvC.
(c) đúng. Mỗi alkyne có 1 liên kết ba, trong liên kết ba gồm 1 liên kết σ và 2 liên kết π.
(d) sai. Chỉ các alkyne có liên kết ba đầu mạch (alkyne-1-yne) mới có phản ứng với dung dịch AgNO3 trong NH3.
Hỗn hợp X gồm một alkane và một alkyne có tỉ lệ mol 1 : 1. Cho 4,958 lít hỗn hợp X (đkc) qua dung dịch Br2, thấy dung dịch mất màu, khối lượng dung dịch tăng 1,6 gam và khí thoát ra có tỉ khối so với H2 là 12,5. Vậy công thức của các chất trong hỗn hợp X là:
nalkane = nalkyne = 0,1 mol
Khí thoát ra gồm alkane và alkyne dư. Gọi số mol alkyne dư là a (mol):
=12,5.2 = 25 ⇒ Alkane là CH4 (vì MCH4 = 16 < 25)
Khối lượng dung dịch bromine tăng bằng khối lượng alkyne phản ứng nên:
malkyne phản ứng = 1,6 gam
⇒ Malkyne.(0,1 – a) = 1,6 (2)
Từ (1) và (2) ⇒ M = 40; a = 0,06
⇒ Alkyne là C3H4.
Chlorine hóa neopentane theo tỉ lệ 1 : 1. Số sản phẩm monochloro thu được là
Công thức cấu tạo của neopentane:
⇒ 4 vị trí nhóm CH3 là như nhau ⇒ thế monochloro thu được 1 sản phẩm duy nhất.
Để tách lấy acetylene từ hỗn hợp với ethylene có thể dùng cách nào sau đây?
Để tách lấy acetylene từ hỗn hợp với ethylene có thể cho hỗn hợp đi qua dung dịch AgNO3 /NH3 dư, sau đó lấy kết tủa tác dụng với dung dịch HCl.
CH≡CH + 2AgNO3 + 2NH3 → Ag–C≡C-Ag + 2NH4NO3
Ag–C≡C-Ag↓ + HCl → CH≡CH + AgCl
Alkane có loại đồng phân nào?
Alkane có đồng phân mạch carbon.
Alkane X có tỉ khối hơi so với He là 14,5. X có số đồng phân là
Theo bài ra ta có: dX/He = 14,5 ⇒ MX = 14,5.4 = 58.
Gọi công thức phân tử của alkane là CnH2n+2.
⇒ 14n + 2 = 58 ⇒ n = 4
Vậy alkane là C4H10.
⇒ X có 2 đồng phân:
CH3-CH2-CH2-CH3
CH3-CH(CH3)-CH3
Dẫn khí acetylene vào ống nghiệm chứa dung dịch AgNO3 trong NH3, hiện tượng quan sát được là
Dẫn khí acetylene vào ống nghiệm chứa dung dịch AgNO3 trong NH3, hiện tượng quan sát được là xuất hiện kết tủa màu vàng nhạt (AgC≡CAg):
HC≡CH + 2AgNO3 + 2NH3 → Ag–C≡C–Ag↓ + 2NH4NO3
Trong công nghiệp, acetylene được điều chế từ chất nào?
Trong công nghiệp, acetylene được điều chế từ CaC2 hoặc từ CH4:
CaC2 + 2H2O → C2H2 + Ca(OH)2
2CH4 C2H2 + 3H2
Dẫn một lượng nhỏ khí chlorine vào bình nón chứa benzene, đậy kín, đưa ra ngoài ánh sáng mặt trời cho phản ứng xảy ra, sản phẩm chính thu được là
C6H6 + 3Cl2 C6H6Cl6
Sản phẩm của phản ứng là C6H6Cl6.
Alkane nào sau đây chứa nguyên tử carbon bậc III?
Alkane chứa nguyên tử carbon bậc III là 2-methylbutane: CH3CH(CH3)CH2CH3.
Cho các chất sau: propane, propene, propyne, butane, but-1-yne, but-2-yne, but-1-ene và cis-but-2-ene. Số chất tác dụng với dung dịch AgNO3 trong NH3 tạo kết tủa là
Các chất tác dụng với dung dịch AgNO3 trong NH3 tạo kết tủa là propyne và but-1-yne gồm: propyne và but-1-yne.
CH≡C−CH3 + AgNO3 + NH3 → CAg≡C−CH3 + NH4NO3
CH≡C−CH2CH3 + AgNO3 + NH3 → CAg≡C−CH2CH3 + NH4NO3
Alkane X có phần trăm khối lượng carbon bằng 75%. Công thức phân tử của X là
Gọi công thức phân tử của alkane X là CnH2n+2 (n ≥ 1).
Ta có:
⇒ n = 1
Vậy alkane là CH4.
Trong các chất đồng phân cấu tạo dạng alkene của C4H8, chất có khả năng cộng hợp HCl tạo một sản phẩm cộng duy nhất là:
HCl là tác nhân bất đối xứng, để alkene C4H8 cộng HCl cho 1 sản phẩn hữu cơ duy nhất thì C4H8 phải đối xứng
Vậy công thức cấu tạo: CH3-CH=CH-CH3.
but-2-ene
Phản ứng đặc trưng của alkene và alkyne là
Do đều chứa liên kết π kém bền trong phân tử, alkene và alkyne có phản ứng đặc trưng là phản ứng cộng.
Trùng hợp chất nào sau đây được polyethylene?
Trùng hợp ethylene thu được polyethylene:
nCH2=CH2 (-CH2–CH2-)n
Khi đốt cháy hoàn toàn 7,437 lít hỗn hợp khí gồm CH4, C2H6, C3H8 (đkc) thu được 17,353 lít khí CO2 (đkc) và x gam H2O. Giá trị của x là
nalkane = 0,3 mol; nCO2 = 0,7 mol
Áp dụng công thức: nalkane = nH2O – nCO2
⇒ nH2O = 0,7 + 0,3 = 1,0 mol
⇒ mH2O = 1,0.18 = 18,0 gam
Đốt cháy hoàn toàn 3,6 gam hydrocarbon X thu được 6,198 lít khí CO2 (đkc). Công thức phân tử của X là
nCO2 = 0,25 (mol)
⇒ mC = 0,25.12 = 3 gam
Mà: mC + mH = 3,6 ⇒ mH = 0,6 gam
Gọi công thức của X là: CxHy ta có:
Vậy công thức của X là: C5H12.
Ở điều kiện thường, chất nào sau đây không làm mất màu dung dịch Br2?
Ở điều kiện thường, chất không làm mất màu dung dịch Br2 là: Propane.
2,8 gam alkene A làm mất màu vừa đủ dung dịch chứa 8 gam Br2. Hydrate hóa A chỉ thu được một alcohol duy nhất. A có tên là
nBr2 = 0,05 mol ⇒ nalkene = nBr2 = 0,05 mol
⇒ Alkene có công thức phân tử là C4H8.
Vì hydrate hóa A chỉ thu được 1 alcohol duy nhất ⇒ A là CH3-CH=CH-CH3 (but-2-ene).
Hydrocarbon thơm A có %C (theo khối lượng) là 92,3%. A tác dụng với dung dịch bromine dư cho sản phẩm có %C (theo khối lượng) là 36,36%. Biết MA < 120. Tên gọi của A là
Gọi công thức phân tử của A là CxHy thì ta có:
⇒ CTĐGN của A là CH ⇒ CTPT có dạng CnHn
Theo đề bài, MA < 120 ⇒ 13n < 120 ⇒ n < 9,23
Mặt khác A là hydrocarbon thơm nên có tối thiểu 6C ⇒ 6 ≤ n < 9,23
Trong phân tử hydrocarbon, số nguyên tử H là số chẵn nên n = 6 hoặc n = 8
- Nếu n = 6 ⇒ A là C6H6
C6H6 + nBr2 → C6H6-nBrn + nHBr
⇒ n = 1,56 (loại)
- Nếu n = 8 ⇒ A là C8H8
C6H5CH=CH2 + Br2 → C6H5CHBr-CH2Br
Vậy A là styrene.
Hợp chất X có công thức phân tử C5H12, khi tác dụng với chlorine (có chiếu sáng) tạo được bốn đẫn xuất thế monochlorine. X là
Khi tác dụng với chlorine (có chiếu sáng) tạo được bốn đẫn xuất thế monochlorine
⇒ X có 4 vị trí thế Cl khác nhau.
Vậy X có công thức CH3CH(CH3)-CH2CH3. Tên gọi của X là isopentane.
Cho benzene vào 1 lọ đựng Cl2 dư rồi đưa ra ánh sáng. Sau khi phản ứng xảy ra hoàn toàn thu được 5,82 kg chất sản phẩm. Khối lượng benzene tham gia phản ứng là:
Sản phẩm thu được là C6H6Cl6:
nC6H6Cl6 = 20 (mol)
C6H6 + 3Cl2 C6H6Cl6
mol: 20 ← 20
⇒ mbenzene = 20.78 = 1560 (g) = 1,56 (kg)
Hợp chất nào sau đây có đồng phân hình học cis-/trans-?
Điều kiện để một chất có đồng phân hình học: Có liên kết đôi và mỗi nguyên tử carbon của liên kết đôi liên kết với hai nguyên tử, nhóm nguyên tử khác nhau.
⇒ Chất có đồng phân hình học dạng cis-/trans- là CH3-CH=CH-CH3.
Dãy gồm các alkene được sắp xếp theo nhiệt độ sôi tăng dần là:
Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của các alkene nói chung tăng theo chiều tăng số nguyên tử carbon trong phân tử.
⇒ Dãy gồm các alkene được sắp xếp theo nhiệt độ sôi tăng dần là: C2H4, C3H6, C4H8, C5H10.
Các hydrocarbon no được dùng làm nhiên liệu do nguyên nhân nào sau đây?
Hydrocarbon no cháy tỏa nhiều nhiệt và có nhiều trong tự nhiên nên được dùng làm nhiên liệu.
Thực hiện phản ứng cracking m gam isobutane, thu được hỗn hợp A gồm các hydrocarbon. Dẫn hỗn hợp A qua bình nước bromine có hòa tan 6,4 gam bromine. Nước bromine mất màu hết, có 5,206 lít hỗn hợp khí B (đkc) gồm các hydrocarbon thoát ra. Tỉ khối hơi B so với hydrogen bằng 117/7. Giá trị của m là:
nBr2 = 0,04 mol; nhh khí = 0,21 mol
Khi dẫn hỗn hợp A gồm các hydrocarbon qua dung dịch bromine, bromine bị mất màu hết ⇒ Alkene trong hỗn hợp A có thể còn dư.
⇒ Khí đi ra khỏi dung dịch bromine có C3H6
⇒ nC3H6 p/ư = nBr2 = 0,04 mol
Áp dụng định luật bảo toàn khối lượng ta có:
mC4H10 = mC3H6 p/ư + m hh khí = 0,04.42 + . 0,21 = 8,7 (g)
Cho các hydrocarbon X có công thức cấu tạo sau:
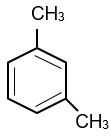
Tên gọi của X là
Đánh số trên vòng sao cho tổng vị trí trên vòng là nhỏ nhất

1,3-dimethylbenzene.
Cho các chất sau: propene, ethylene, acetylene, benzene, xylene, toluene và naphthalene. số chất ở thể khí trong điều kiện thường là:
Thể khí: methane, ethylene, acetylene.
Thể lỏng: benzene, toluene.
Thể rắn: naphthalene.
Số liên kết π (pi) có trong phân tử vinylacetylene (CH2=CH–C≡CH) là
Số liên kết π (pi) có trong phân tử vinylacetylene (CH2=CH–C≡CH) là 3: Trong mỗi liên kết đôi chứa 1 liên kết π và 1 liên kết σ, mỗi liên kết ba chứa 2 liên kết π và 1 liên kết σ
Dẫn hỗn hợp khí X gồm ethylene và acetylene qua bình đựng dung dịch AgNO3 trong NH3 dư đến khi phản ứng xảy ra hoàn toàn thu được 28,8 gam kết tủa và thấy có 2,223 lít khí (đo ở đkt) thoát ra. Phần trăm khối lượng của acetylene trong X là
C2H2 và C2H4 cho qua dung dịch AgNO3 chỉ có C2H2 phản ứng ⇒ khí đi ra là khí C2H4.
BTNT C: nC2H2 = nAg2C2 = = 0,12 (mol)
= 46,15%
Propane có công thức cấu tạo là
Propane có công thức cấu tạo là CH3-CH2-CH3.
Vì là các chất đều là alkene nên khi cháy cho:
nCO2 = nH2O = 0,12 (mol)
Bảo toàn O:
⇒ b = VO2 = 0,18.24,79 = 4,4622 lít
Có thể dùng một chất nào trong các chất sau đây để nhận biết ba chất lỏng đựng trong các lọ mất nhãn: hex-1-yne, toluene, benzene?
Có thể dùng dung dịch KMnO4 để nhận biết:
- Hex-1-yne: làm mất màu dung dịch KMnO4 ở nhiệt độ thường.
- Toluene: làm mất màu dung dịch KMnO4 khi đun nóng.
- Benzene: không phản ứng, không có hiện tượng.
