Số liên kết của nguyên tử halogen phân tử dẫn xuất halogen của hydrocarbon là:
Số liên kết của nguyên tử halogen phân tử dẫn xuất halogen của hydrocarbon là 1
Số liên kết của nguyên tử halogen phân tử dẫn xuất halogen của hydrocarbon là:
Số liên kết của nguyên tử halogen phân tử dẫn xuất halogen của hydrocarbon là 1
Danh pháp thay thế của CH3COCH2CH3 là:
Chia hỗn hợp gồm hai aldehyde no, đơn chức làm hai phần bằng nhau. Phần (1) đem đốt cháy hoàn toàn thu được 3,6 gam nước. Phần (2) đem khử hoàn toàn bằng LiAlH4 thu được hỗn hợp X. Đem đốt cháy hoàn toàn hỗn hợp X thì thu được thể tích khí CO2 (đkc) là
- Phần 1: Aldehyde no, đơn chức đem đốt cháy ⇒ nCO2 = nH2O = 0,2 mol.
- Phần 2: Aldehyde X
Ta thấy số C trong X và aldehyde lúc đầu không thay đổi ⇒ đốt cháy X thu được lượng CO2 bằng phần 1.
⇒ V = 0,2.24,79 = 4,958 lít.
Một arene Y có phần trăm khối lượng carbon bằng 92,307%. Trên phổ khối lượng của Y có peak ion phân tử ứng với giá trị m/z = 104. Công thức cấu tạo phân tử của Y là
Công thức phân tử của Y là C8H8.
Vì Y là arene nên phân tử có vòng benzene.
Vậy Y có công thức cấu tạo C6H5C2H3 hay C6H5CH=CH2.
Phát biểu nào sau đây là không đúng?
Có chất trong phân tử có vòng benzene nhưng không là hydrocarbon thơm.
Ví dụ: potassium benzoate.
Tên thay thế của hợp chất có công thức CH3CH(C2H5)CH(OH)CH3 là
Tên theo danh pháp thay thế của alcohol đơn chức:
Tên hydrocarbon (bỏ kí tự e ở cuối) - Số chỉ vị trí nhóm OH - ol.
Vậy tên đúng của hợp chất là: 3-methylpentan-2-ol
Một dung dịch chứa 6,1 gam chất X là đồng đẳng của phenol đơn chức. Cho dung dịch trên tác dụng với nước bromine dư thu được 17,95 gam hợp chất Y chứa 3 nguyên tử Br trong phân tử. Biết hợp chất này có nhiều hơn 3 đồng phân cấu tạo. Công thức của X là
Gọi a là số mol của X:
X + 3Br2 → Y + 3HBr
a 3a 3a
nBr2 = nHBr = a
Áp dụng ĐLBTKL:
mX + mBr2 = mhợp chất + mHBr
⇒ 6,1 + 160.3a = 17,95 + 81.3a
⇒ a = 0,05 mol
⇒ MX = 6,1/ 0,05 = 122 (g/mol)
⇒ X có thể là C2H5C6H4OH hoặc (CH3)2C6H3OH
Ta có: X có nhiều hơn 3 đồng phân cấu tạo
⇒ X chỉ có thể là (CH3)2C6H3OH.
Đun sôi 7,85 gam C3H7Cl với hỗn hợp KOH/C2H5OH dư, sau khi loại tạp chất và dẫn khí sinh ra qua dung dịch brom dư thấy có x gam Br2 tham gia phản ứng. Tính x nếu hiệu suất phản ứng ban đầu là 85%.
nC3H7 = 0,1 mol
C3H7Cl C3H6 + HCl
0,1 0,1
Do hiệu suất phản ứng là 80% nên:
nC3H6 = 0,85.0,1 = 0,085 mol
C3H6 + Br2 C3H6Br2
0,085 0,085
x = 0,085.160 = 13,6 gam
Hợp chất thơm X có công thức phân tử C7H8O. X có thể tác dụng với Na và NaOH. Số đồng phân X thỏa mãn là:
X có thể tác dụng với Na và NaOH nên X là phenol.
Vậy X có 3 đồng phân là:
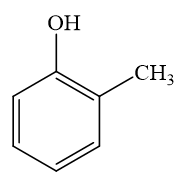
2-metylphenol
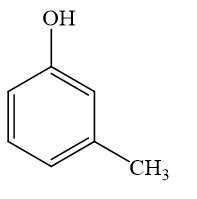
3-metylphenol;
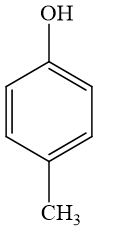
4-metylphenol
Sản phẩm chính của phản ứng cộng HX (X là OH, Cl, Br,…) vào alkene bất đối xứng tuân theo quy tắc nào sau đây?
Sản phẩm chính của phản ứng cộng HX (X là OH, Cl, Br,…) vào alkene bất đối xứng tuân theo quy tắc Markovnikov.
Ethyl alcohol có công thức cấu tạo là:
Ethyl alcohol có công thức cấu tạo là CH3CH2OH
Nguyên nhân phản ứng thế bromine vào vòng thơm của phenol xảy ra dễ dàng hơn so với benzene là do
Nguyên nhân phản ứng thế bromine vào vòng thơm của phenol xảy ra dễ dàng hơn so với benzene là do ảnh hưởng của nhóm -OH đến vòng benzene trong phân tử phenol.
Đốt cháy hoàn toàn 9 g carboxylic acid A thu được 8,8 g CO2. Để trung hòa cũng lượng acid này cần dùng 200 ml dung dịch NaOH 1M. Tên của A là:
nCO2 = 8,8/44 = 0,2 mol; nNaOH = 0,2.1 = 0,2 mol
R(COOH)a + aNaOH → R(COONa)a + H2O
x ax
nNaOH = ax = 0,2 mol
Mặt khác:
(MR + 45a)x = 9
⇔ MR.x + 45ax = 0
⇔ MR.x + 45. 0,2 = 9
MR.x = 0
MR = 0
Công thức cấu tạo của A là: (COOH)2 oxalic acid.
Kết luận nào sau đây không đúng?
Phát biểu không đúng là phenol là acid yếu, tác dụng với dung dịch kiềm và làm đổi màu quỳ tím.
Vì phenol là acid yếu không làm đổi màu quỳ tím.
Hiện nay nguồn nguyên liệu chính để sản xuất aldehyde acetic trong công nghiệp là
Nguồn nguyên liệu chính để sản xuất aldehyde acetic trong công nghiệp là ethylene:
2CH2=CH2 + O2 2CH3CHO
Phenol là hợp chất hữu cơ có tính
Trong phân tử phenol, do ảnh hưởng của vòng benzene nên liên kết O-H của phenol phân cực mạnh hơn so với alcohol, vì vậy phenol thể hiện tính acid yếu.
Hỗn hợp X gồm CnH2n-1CHO; CnH2n-2(CHO)2; CnH2n-2(COOH)2; CnH2n-3(CHO)(COOH)2. Cho m gam hỗn hợp X tác dụng với dung dịch AgNO3/NH3 dư thu được 56,16 gam Ag. Trung hòa m gam hỗn hợp X cần dùng 30 gam dung dịch hỗn hợp NaOH 12% và KOH 5,6%. Đốt m gam hỗn hợp X cần dùng (m + 7,29) gam O2. Giá trị gần nhất của m là
Ta có:
nCOO = nNaOH + nKOH = 0,09 + 0,03 = 0,12 mol
nCO = nAg/2 = 0,52/2 = 0,26 mol
-COO đốt cháy thành CO2
-CO đốt cháy cần một O thành CO2
-CH2 đốt cháy cần một O thành H2O và hai O thành CO2
⇒ 2.nO2 cần dùng = 1.nCO + 3.nCH2
⇒ m = 19,02 gam
(CH3)2CHCH2COOH có tên gọi theo danh pháp thay thế là
(CH3)2CHCH2COOH có tên gọi theo danh pháp thay thế là 3-methylbutanoic acid.
Chất nào sau đây là đồng phân của CH3C≡C-CH3?
CH≡C-CH2-CH3 và CH3-C≡C-CH3 có cùng công thức phân tử là C4H6 nên chúng là đồng phân của nhau.
Cho glycerol tác dụng với acetic acid thì có thể sinh ra bao nhiêu loại ester?
Glycerol tác dụng với acetic acid thì có thể sinh ra 5 loại ester:
CH3COOCH2CH(OH)CH2OH
HOCH2CH(OOCCH3)CH2OH
CH3COOCH2CH(OOCCH3)CH2OH
CH3COOCH2CH(OH)CH2OOCCH3
(CH3COO)3C3H5
Các alkene và alkyne là hydrocarbon không no dễ tham gia phản ứng cộng, trùng hợp, oxi hóa là do
Do đều chứa liên kết π kém bền trong phân tử, alkene và alkyne có phản ứng đặc trưng là phản ứng cộng.
Alkene và alkyne đều có khả năng tham gia phản ứng cộng với H2, X2, HX, H2O, … (X là Cl, Br).
X là alcohol đơn chức no hở, Y là acid carboxylic no hở đơn chức. Biết MX = MY. Phát biểu đúng là
Gọi công thức của X là CnH2n+2O
Y là CmH2mO2
Vì MX = MY nên 14n + 18 = 14m + 32
→ 14n = 14m + 14
→ n = m + 1
Phát biểu nào sau đây về tính chất của hợp chất carbonyl là không đúng?
Aldehyde bị khử bằng NaBH4 sinh ra alcohol bậc một, ketone bị khử bằng NaBH4 sinh ra alocohol bậc hai.
Công thức tổng quát của carboxylic acid no, đơn chức, mạch hở là
Công thức tổng quát của carboxylic acid no, đơn chức, mạch hở là
CnH2nO2 (n ≥ 1).
Có thể phân biết 3 lọ mất nhãn chứa: HCOOH, CH3COOH, C2H5OH bằng hóa chất nào dưới đây?
Phân tích các đáp án:
Nếu dùng dung dịch AgNO3/NH3 chỉ phân biệt được HCOOH.
NaOH chỉ nhận biết được C2H5OH không phản ứng
Cả 3 chất đều phản ứng với Na không thể nhận biết được
Cu(OH)2/OH-
Tác dụng với với CH3COOH như bình thường còn HCOOH tạo kết tủa đỏ gạch
Không phản ứng với C2H5OH.
Acetaldehyde không tác dụng được với
CH3CHO + Br2 + H2O → CH3COOH + 2HBr
CH3CHO + 3O2 2CO2 + 2H2O
CH3CHO + 2AgNO3 + 3NH3 CH3COONH4 + 2NH4NO3 + 2Ag
Acetaldehyde không tác dụng được với Na.
Sản phẩm thủy phân của chất nào sau đây có thể tham gia phản ứng tráng gương?
Sản phẩm thủy phân của chất có thể tham gia phản ứng tráng gương:
CH3CHCl2 + 2NaOH CH3CHO + 2NaCl + H2O
Trong các hợp chất hữu cơ có công thức phân tử sau đây, chất nào không thể là aldehyde?
Aldehyde thuộc hợp chất carbonyl.
Aldehyde no, đơn chức có công thức tổng quát CnH2nO.
Vậy C4H10O không thể là công thức của aldehyde.
Đốt cháy 0,2 mol rượu no đơn chức mạch hở thu được 8,8g CO2 và m(g) H2O. Gá trị của m là:
Gọi công thức phân tử của alcohol là CnH2n+2O
CnH2n+2O + 3n/2 O2 → nCO2 + (n+1)H2O
1 n n+1
0,1 0,1n 0,1(n+1)
n = 2
nH2O = 0,1(n + 1) = 0,1n + 0,1 = 0,3 (mol)
mH2O = 0,3.18 = 5,4(g)
Phenol phản ứng với chất, dung dịch nào sau đây sinh ra chất khí:
Phenol phản ứng với kim loại Na sinh ra chất khí hydrogen
Phương trình phản ứng minh họa:
C6H5OH + Na → C6H5ONa + 1/2H2
Ứng dụng nào sau đây không phải của formaldehyde?
Formaldehyde không được dùng để sản xuất acetic acid.
Bậc của dẫn xuất halogen là bậc của nguyên tử carbon liên kết với nguyên tử halogen. Bậc của dẫn xuất halogen nào sau đây là không phù hợp?
Carbon có tối đa 4 liên kết, nên không thể có dẫn xuất halogen bậc IV.
Khi cho alkane X tác dụng với chlorine thu được dẫn xuất monochloro Y trong đó chlorine chiếm 33,33 % khối lượng. X là:
Gọi công thức phân tử của X là CnH2n+1Cl:
n = 5
Y là C5H11Cl
X là C5H12
Cho các dẫn xuất sau: CH3Cl, CH3F, CH3Br, CH3I. Thứ tự nhiệt độ sôi đúng là:
Thứ tự nhiệt độ sôi đúng là: CH3F < CH3Cl < CH3Br < CH3I.
| Dẫn xuất halogen | Nhiệt độ sôi (°C) |
| CH3F | -78,4 °C |
| CH3Cl | -24,2 °C |
| CH3Br | 3,6 °C |
| CH3I | 42,4 °C |
Đốt cháy hoàn toàn 2,479 lít hydrocarbon X thu được 7,437 lít CO2 (các thể tích khí đo ở đkc). X tác dụng với dung dịch AgNO3 trong NH3 sinh ra kết tủa màu vàng. Công thức cấu tạo của X là
nX = 0,1 (mol); nCO2 = 0,3 (mol)
X tác dụng với dung dịch AgNO3 trong NH3 sinh ra kết tủa màu vàng ⇒ X là alkyne.
Gọi công thức phân tử của X là CnH2n-2 (n ≥ 2).
Phương trình hóa học:
CnH2n-2 + O2
nCO2 + (n – 1)H2O
mol: 0,1 → 0,1n
⇒ 0,1n = 0,3
⇒ n = 3
Vậy X là C3H4, công thức cấu tạo của X là CH3-C≡CH.
Phản ứng nào sau đây không tạo ra ethanal?
Phản ứng khôngh tạo ra ethanal:
CH3OH + CuO HCHO + Cu + H2O
Dung dịch acetic acid phản ứng được với tất cả các chất trong dãy nào sau đây?
Phương trình phản ứng:
2CH3COOH + Zn → (CH3COO)2Zn + H2
CH3COOH + KOH → CH3COOK + H2O
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
Cho các chất: (1) CHCl2-COOH ; (2) CH2Cl-COOH ; (3) CCl3-COOH . Dãy sắp xếp đúng theo thứ tự giảm dần tính acid là
Gốc Cl hút e làm tăng độ phân cực của liên kết O-H → Làm tăng tính acid
Hợp chất càng có nhiều gốc Cl thì tính acid càng mạnh
Vậy tính acid của CCl3-COOH > CHCl2-COOH > CH2Cl-COOH.
X là hỗn hợp gồm 2 alcohol đồng phân cùng công thức phân tử C4H10O. Đun X với H2SO4 ở 170oC chỉ được một alkene duy nhất. Vậy X gồm:
2-methylpropanoic acid có công thức cấu tạo là
2-methylpropanoic acid có công thức cấu tạo là (CH3)2CHCOOH.
