Trường hợp 1: Nếu chỉ có 1 hydrocarbon phản ứng với dung dịch Bromine thì ta có:
nC2H2 = 1/2.nBr2 = 0,175 mol
⇒ nC3H8 = 0,2 - 0,175 = 0,025 mol
⇒ mhỗn hợp = 0,175.26 + 0,025.44 = 5,65 ≠ 6,7 (Loại)
Trường hợp 2: Cả hai hydrocarbon cùng phản ứng với dung dịch nước bromine
nX = 4,958 : 24,79 = 0,2 mol;
nBr2 ban đầu = 1,4.0,5 = 0,7 mol;
nBr2 pư = 0,7 : 2 = 0,35 mol
Khối lượng bình Br2 tăng 6,7 gam là số gam của hỗn hợp X. Đặt công thức trung bình của hai hydrocarbon mạch hở là  (
( là số liên kết
là số liên kết  trung bình)
trung bình)
Phương trình phản ứng:

0,2 → 0,2 = 0,35 (mol)
= 0,35 (mol)
⇒  = 0,35 : 0,2 = 1,75
= 0,35 : 0,2 = 1,75
⇒ Trong hỗn hợp có một chất chứa 2 liên kết  chất còn lại chứa 1 liên kết
chất còn lại chứa 1 liên kết  .
.
⇒ 14 + 2 - 2
+ 2 - 2 = 6,7:0,2 ⇒
= 6,7:0,2 ⇒  = 2,5
= 2,5
⇒ Trong hỗn hợp phải có một chất là C2H2 (có hai liên kết  ) chất còn lại phải có một liên kết
) chất còn lại phải có một liên kết  và có số C từ 3 trở lên đó là C4H8.
và có số C từ 3 trở lên đó là C4H8.









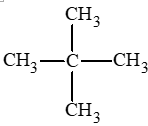



 : 2,2 – dimethylpropane
: 2,2 – dimethylpropane