Trong công nghiệp acetylene được điều chế bằng cách.
Trong công nghiệp acetylene được điều chế bằng cách nhiệt phân methane ở 1500oC, làm lạnh nhanh
2CH4 C2H2 + 3H2
Trong công nghiệp acetylene được điều chế bằng cách.
Trong công nghiệp acetylene được điều chế bằng cách nhiệt phân methane ở 1500oC, làm lạnh nhanh
2CH4 C2H2 + 3H2
Các alkene và alkyne là hydrocarbon không no dễ tham gia phản ứng cộng, trùng hợp, oxi hóa là do
Do đều chứa liên kết π kém bền trong phân tử, alkene và alkyne có phản ứng đặc trưng là phản ứng cộng.
Alkene và alkyne đều có khả năng tham gia phản ứng cộng với H2, X2, HX, H2O, … (X là Cl, Br).
Alkane CH3-CH2-CH(CH3)-CH2-CH3 có tên gọi là:
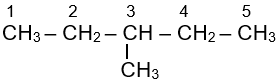
3-methylpentane
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm methane, ethane, propane bằng oxygen không khí (trong không khí, oxygen chiếm 20% thể tích), thu được 8,6765 lít khí CO2 (ở đkc) và 9,9 gam nước. Thể tích không khí (ở dkc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là:
nCO2 = 8,6765 : 24,79 = 0,35 mol
nH2O = 9,9 : 18 = 0,55 mol
Hydrocarbon + O2 → CO2 + H2O
Áp dụng định luật bảo toàn nguyên tố, ta có:
nO2 = (2nCO2 + nH2O) : 2 = 0,625 mol
⇒ Vkk = nO2×24,79.5 = 0,625×24,79×5 = 77,47 L
Dẫn 1,2395 lít Hydrocarbon X (đkc) vào dung dịch bromine thì làm mất màu vừa đủ dung dịch chứa 8 gam bromine cho ra sản phẩm có hàm lượng bromine đạt 69,56%. Tìm công thức phân tử của X.
nX = 1,2395: 24,79 = 0,05 mol
nBr2 = 8 : 160 = 0,05 = nX
⇒ X là alkene: CnH2n (n ≥ 2)
Phương trình phản ứng tổng quát
CnH2n + Br2 → CnH2nBr2
⇒ 14n + 2.80 = 230 ⇒ n = 5:
Vậy công thức phân tử của X là C5H10.
Đốt cháy hoàn toàn một hydrocarbon A. Sản phẩm thu được hấp thụ hoàn toàn vào 400 mL dung dịch Ca(OH)2 0,2M thấy thu được 6 gam kết tủa. Lọc bỏ kết tủa cân lại phần dung dịch thấy khối lượng tăng lên so với ban đầu là 0,56 gam. Hydrocarbon có công thức phân tử là:
n kết tủa = 6:100 = 0,06 mol
nCa(OH)2 = 0,4.0,2 = 0,08 mol
Có hai trường hợp xảy ra:
Trường hợp 1:
Ca(OH)2dư, chỉ xảy ra phản ứng tạo kết tủa :
CO2 + Ca(OH)2 → CaCO3+ H2O (1)
0,06 0,06 0,06
m dung dịch tăng = mH2O + mCO2 − mCaCO3 = 0,56 gam
⇒ mH2O = 0,56 + 6 − 0,06.44 = 3,92 gam
⇒ nH2O = 0,2178 mol ⇒ nH = 0,4356 mol
⇒ nC:nH = 0,06 : 0,4356 = 1 : 7,26 (loại)
Trường hợp 2: Ca(OH)2 phản ứng hết
CO2 + Ca(OH)2 → CaCO3+ H2O (1)
0,06 → 0,06 → 0,06
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
0,04 ← 0,02
⇒ nCO2 = 0,06 + 0,04 = 0,1 mol.
mdung dịch tăng = mH2O + mCO2 − mCaCO3 = 0,56 gam
⇒ mH2O = 0,56 + 6 − 0,1.44 = 2,16 gam
⇒ nH2O = 0,12 mol ⇒ nH = 0,24 mol
⇒ nC : nH = 0,1 : 0,24 = 5 : 12
Vậy công thức phân tử của alkane là C5H12
Sản phẩm chính của sự dehydrate hóa 2-methylbutane-2-ol là chất nào?
Phản ứng hydrate hóa alkene cũng tuân theo quy tắc Markovnikov: nhóm -OH ưa tiên tách ra cùng với H ở carbon bậc cao hơn bên cạnh để tạo thành sản phẩm chính.
(CH3)2-C(OH)-CH2-CH3 (CH3)2-C=CH-CH3 + H2O
2-methylbutane-2-ol 2-methylbut-2-ene
Dẫn 12,96 gam but-1-yne qua dung dịch AgNO3/NH3 dư, sau phản ứng thu x gam kết tủa. Giá trị của x là:
nbut-1-yne = 12,96 : 54 = 0,24 mol
Phương trình phản ứng
CH3–CH2–C≡CH + AgNO3 + NH3 → CH3–CH2–C≡CAg ↓vàng nhạt + NH4NO3
0,24 → 0,24
⇒ nkết tủa = nC4H6 = 0,24 mol
⇒ m = 0,24.161 = 38,64 gam
Tên thay thế alkene có công thức CH3-CH=CH-CH3.
![]()
but – 2 – ene
Để phân biệt giữa ethane và ethene, dùng phản ứng nào là thuận tiện nhất?
Ethene làm mất màu dung dịch brom còn ethane thì không.
CH2 = CH2 + Br2 → CH2Br – CH2Br
Tên arene sau theo danh pháp thay thế là:
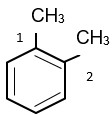
1,2-dimethylbenzene.
Biện pháp nào sau đây làm giảm ô nhiễm môi trường gây ra do sử dụng nhiên liệu từ dầu mỏ?
Đưa thêm chất xúc tác vào ống xả động cơ để chuyển hóa các khí thải độc hại là biện pháp giảm thải các khí gây ô nhiễm môi trường do đốt cháy xăng dầu trong động cơ.
Nitro hóa benzene bằng hỗn hợp HNO3 đặc và H2SO4 đặc ở nhiệt độ không quá 50oC, tạo thành chất hữu cơ X. Phát biểu nào sau đây về X không đúng?
X là nitrobenzene lỏng có màu vàng, sánh như dầu không tan trong nước.
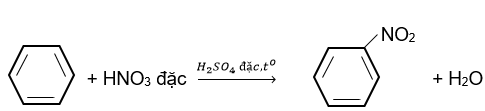
Chất nào sau đây dùng làm đèn xì hàn, cắt kim loại?
Khí được ứng dụng trong đèn xì để hàn cắt kim loại là: Acetylene.
Ứng với công thức phân tử C8H10, có bao nhiêu arene là đồng phân cấu tạo của nhau?
Ứng với công thức phân tử C8H10, có 4 arene là đồng phân cấu tạo của nhau
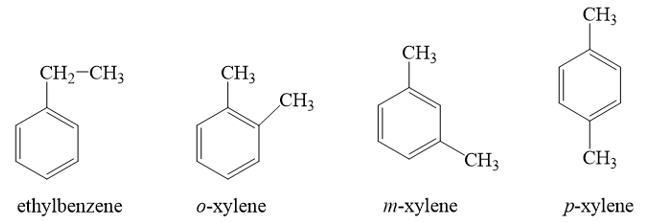
Cho các phản ứng sau:
![]()
![]()
![]()
![]()
![]()
![]()
Số phản ứng thuộc loại phản ứng thế là:
Phản ứng (1) và (5) là phản ứng thế.
(5) CH≡CH + 2AgNO3 + 2NH3 → Ag–C≡C-Ag↓ + 2NH4NO3
Đốt cháy hoàn toàn hydrocarbon A cần vừa đủ 3,9664 lít O2 (Đkc), tạo ra 4,4 gam CO2. Công thức phân tử A là:
nO2 = 3,9664 : 24,79 = 0,16 mol,
nCO2 = 4,4 : 44 = 0,1 mol
Bảo toàn nguyên tố O ta có:
2nO2 = 2n CO2 + nH2O ⇒ nH2O = 0,16.2 - 2.0,1 = 0,12 mol
Ta có nCO2 < nH2O ⇒ Hydrocarbon A là alkane
⇒ nalkane = nH2O – nCO2 = 0,12– 0,1 = 0,02 mol
Số C = 0,1 : 0,02 = 5 ⇒ Công thức của alkane là C5H12
Phản ứng nào của alkane ban đầu tạo thành sản phẩm có nhiều mạch nhánh hơn hoặc mạch vòng?
Reforming alkane là quá trình chuyển các alkane mạch không phân nhánh thành các alkane mạch phân nhánh và các hydrocarbon mạch vòng nhưng không làm thay đổi số nguyên tử carbon trong phân tử và cũng không làm thay đổi đáng kể nhiệt độ sôi của chúng.
Công thức phân tử nào dưới đây không thể là của một arene?
Arene hay còn gọi là hydrocarbon thơm là những hydrocarbon trong phân tử có chứa một hay nhiều vòng benzene
Arene có nhóm thế no, có công thức chung là C n H 2n-6 (n ≥ 6) : CnH2n-6 (n ≥ 6).
Vậy đáp án C11H18 không chính xác
Phát biểu nào sau đây sai khi nói về tính chất vật lí của alkane:
Ở điều kiện thường, alkane từ C1 đến C4 và neopentane ở trạng thái khí, alkane từ C5 đến C17 (trừ neopentane) ở trạng thái lỏng, không màu, alkane từ C18 trở lên là chất rắn màu trắng (còn gọi là sáp paraffin).
Do đó Butane ở điều kiện thường ở trạng thái khí, còn pentane ở trạng thái lỏng
Các chai, lọ túi, màng mỏng trong suốt, không độc, được sử dụng làm chai đựng nước, thực phẩm, mảng bọc thực phẩm được sản xuất từ polymer của chất nào sau đây?
Polyethylene được dùng làm bao bì và các đồ dùng như li, cốc, tủ chứa đồ,…
Công thức phân tử của anthracene là:
Công thức phân tử của anthracene C14H10
Trong số các hydrocarbon mạch hở sau: C4H10, C4H6, C4H8, C2H2, những hydrocarbon nào có thể tạo kết tủa với dung dịch AgNO3/NH3
Hydrocarbon C4H6, C2H2 có thể tạo kết tủa với dung dịch AgNO3/NH3
Khi đốt cháy hoàn toàn V lít hỗn hợp khí CH4, C2H6, C3H8 (đkc) thu được 5,28 gam CO2 và 3,456 gam H2O. Giá trị của V là:
nCO2 = 5,28 : 44 = 0,12 mol
nH2O = 3,456 : 18 = 0,192 mol
Hỗn hợp khí CH4, C2H6, C3H8 đều là alkane
⇒ nalkane = nH2O - nCO2 = 0,192 - 0,12 = 0,072 mol
Valkane = 0,072.24,79 = 1,78488 L
Ở điều kiện thường, chất nào sau đây tồn tại ở thể khí?
Ở điều kiện thường:
- Methane là chất khí
- Benzene, toluene là chất lỏng
- Phenol là chất rắn
Cho phản ứng: C2H2 + H2O ![]() A. A là chất nào dưới đây?
A. A là chất nào dưới đây?
Phương trình hóa học
C2H2 + H2O CH3CHO
A là chất CH3CHO
Trong phản ứng cracking alkane thì
Cracking alkane là quá trình phân cắt liên kết C–C (bẻ gãy mạch carbon) của các alkane mạch dài để tạo thành hỗn hợp các hydrocarbon có mạch carbon ngắn hơn.
Ví dụ:
C3H8 CH4 + C2H4
Cho phản ứng sau:
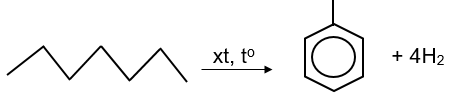
Phản ứng trên thuộc loại phản ứng:
Reforming alkane là quá trình chuyển các alkane mạch không phân nhánh thành các alkane mạch phân nhánh và các hydrocarbon mạch vòng nhưng không làm thay đổi số nguyên tử carbon trong phân tử và cũng không làm thay đổi đáng kể nhiệt độ sôi của chúng.
Phản ứng reforming
Nguyên nhân nào làm cho các alkane tương đối trơ về mặt hóa học
Trong phân tử alkane chỉ chứa các liên kết đơn C – C và C – H, các liên kết này là liên kết σ bền vững và kém phân cực. Do vậy, phân tử alkane hầu như không phân cực và ở điều kiện thường chúng tương đối trơ về mặt hoá học.
Một arene X có phần trăm khối lượng carbon bằng 92,307%. Trên phổ khối lượng của X có peak ion phân tử ứng với giá trị m/z = 104. Công thức cấu tạo phân tử của X là
X là aren nên hợp chất gồm các nguyên tố C, H.
Gọi công thức tổng quát của arene X là CxHy
Theo đề bài ta tìm được % khối lượng của H trong X: 100% - 92,307% = 7,693%.
⇒ Công thức thực nghiệm của X là: (CH)n
Ta có:
MX = 104 ⇒ 13n = 104 ⇒ n = 8
Công thức phân tử của chất X là C8H8
Vậy công thức cấu tạo là C6H5CH=CH2
Cho các chất có công thức cấu tạo sau: (1) ClCH2CH=CHCH3; (2) CH3CH=CHCH3; (3) BrCH2C(CH3)=C(CH2CH3)2; (4) ClCH2CH=CH2; (5) ClCH2CH=CHCH2CH3; (6) (CH3)2C=CH2. Trong số các chất trên, bao nhiêu chất có đồng phân hình học?
Các chất có đồng phân hình học khi trong nguyên tử có liên kết đôi, và nguyên tử carbon ở liên kết đôi liên kết với các nguyên tử/ nhóm nguyên tử khác nhau.
⇒ Các chất (1), (2) và (5) có đồng phân hình học.
Cho các chất sau: propene, ethylene, acetylene, benzene, xylene, toluene và naphthalene. số chất ở thể rắn trong điều kiện thường là:
propene, ethylene, acetylene ở thể khí
benzene, xylene, toluene ở thể lỏng
naphthalene ở thể rắn
Hợp chất nào sau đây là một alkyne?
Alkyne là hydrocarbon không no, mạch hở, có một liên kết ba (C≡C) trong phân tử, có công thức chung là CnH2n-2 (n≥ 2).
Các alkane C11 đến C20 (vaseline) là nguyên liệu để sản xuất
Các alkane từ C11 đến C20 (vaseline) được dùng làm kem dưỡng da, sáp nẻ, thuốc mỡ.
Hiện tượng xảy ra khi cho bromine lỏng vào ống nghiệm chứa benzene, lắc nhẹ hỗn hợp?
Hỗn hợp tách lớp và bromine lỏng không bị mất màu do benzene chỉ tác dụng với bromine khan có xúc tác bột sắt.
Trong phân tử methane, phát biểu nào sau đây không đúng?
Trong phân tử methane, bốn liên kết C-H giống nhau tạo với nhau một góc 109,5o và hướng về bốn đỉnh của một tứ diện đều.
Liên kết C-H ít bị phân cực
Trong công nghiệp ethylene được điều chế bằng cách:
Trong công nghiệp, alkene thường được điều chế bằng phản ứng cracking alkane trong dầu mỏ.
Ở điều kiện thường hydrocarbon nào sau đây ở thể lỏng?
Ở điều kiện thường, alkane từ C1 đến C4 và neopentane ở trạng thái khí, alkane từ C5 đến C17 (trừ neopentane) ở trạng thái lỏng, không màu, alkane từ C18 trở lên là chất rắn màu trắng (còn gọi là sáp paraffin).
Ở điều kiện thường hydrocarbon C5H12 ở thể lỏng
Số dẫn xuất một lần thế được tạo thành khi chlorine hóa 2,2-dimethylproane trên là:
2,2-dimethylproane tác dụng với Cl2(as) theo tỉ lệ mol 1:1 thu được 1 dẫn xuất monoclo:
CH3-C(CH3)2-CH3+ Cl2 CH3-C(CH3)2-CH2Cl + HCl
Phân tử methane không tan trong nước vì
Phân tử methane không tan trong nước vì phân tử methane không phân cực.
