Bộ đề thi học kì 2 KHTN 7 phân môn Hóa học
Bộ đề thi học kì 2 KHTN 7 phân môn Hóa học gồm các đề thi giúp bạn học ôn luyện, củng cố kiến thức cũng như rèn luyện kĩ năng làm bài.|
SỞ GIÁO DỤC VÀ ĐÀO TẠO TRƯỜNG THCS………………. |
ĐỀ THI HỌC KÌ II Môn: KHOA HỌC TỰ NHIÊN 7 Thời gian làm bài: … phút (không kể thời gian giao đề) Đề số 1 |
Họ và tên học sinh: …………………………………………… Lớp: 7……..
Phần I: Trắc nghiệm (6,0 điểm)
Câu 1: Trong nguyên tử, hạt mang điện tích dương là
| A. electron. | B. proton. | C. neutron. | D. proton và electron. |
Câu 2: Kí hiệu nào sau đây là kí hiệu hóa học của nguyên tố magnesium?
| A. mg. | B. mG. | C. MG. | D. Mg |
Câu 3: Iron có hóa trị III trong công thức nào sau đây?
| A. FeO. | B. Fe2O3. | C. FeSO4. | D. FeCl2. |
Câu 4: Trong phân tử chlorine (Cl2), khi hai nguyên tử chlorine liên kết với nhau, chúng
A. góp chung proton.
B. chuyển electron từ nguyên tử này sang nguyên tử kia.
C. chuyển proton từ nguyên tử này sang nguyên tử kia.
D. góp chung electron.
Câu 5: Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo nguyên tắc
| A. chiều nguyên tử khối tăng dần. | B. chiều điện tích hạt nhân tăng dần. |
| C. tính kim loại tăng dần. | D. tính phi kim tăng dần. |
Câu 6: Khối lượng phân tử của BaCO3 là
| A. 197 amu. | B. 137 amu. | C. 157 amu. | D. 177 amu. |
Câu 7: Nguyên tử nguyên tố argon (Z = 18) có bao nhiêu lớp electron?
| A. 2 lớp. | B. 1 lớp. | C. 3 lớp. | D. 4 lớp. |
Câu 8: Nguyên tố hóa học là những nguyên tử có cùng
| A. nguyên tử khối. | B. số proton. | C. số khối. | D. số neutron. |
Câu 9: Đây là sơ đồ nguyên tử nguyên tố nào?
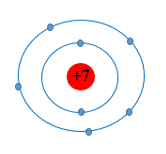
| A. Na. | B. N. | C. Al. | D. O. |
Câu 10: Nguyên tố oxygen có cùng số lớp electron với nguyên tố nào sau đây?
| A. Chlorine. | B. Fluorine. | C. Bromine. | D. Sulfur. |
Câu 11: Nguyên tố X thuộc nhóm VIIA, chu kì 3. Điện tích hạt nhân nguyên tử nguyên tố X là
| A. +17. | B. +16. | C. +15. | D. +20. |
Câu 12: Tính chất của nguyên tố bromine gần giống với tính chất của nguyên tố nào sau đây?
| A. Phosphorus. | B. Nitrogen. | C. Chlorine. | D. Sulfur. |
Câu 13: Số nguyên tố trong chu kỳ 3 và 5 là:
| A. 8 và 8. | B. 8 và 18. | C. 18 và 8. | D. 18 và 18. |
Câu 14: Cho các hợp chất sau: MgCl2, Na2O, NH3, HCl, NaCl. Hợp chất nào có liên kết cộng hóa trị?
| A. HCl và NaCl. | B. Na2O và NH3. | C. MgCl2 và Na2O. | D. NH3 và HCl. |
Câu 15: Nguyên tử của nguyên tố Y có 3 lớp electron, lớp electron ngoài cùng có 2 electron. Vị trí của nguyên tố X là
| A. thuộc chu kì 3, nhóm VIA. | B. thuộc chu kì 3, nhóm IIA. |
| C. thuộc chu kì 2, nhóm IIIA. | D. thuộc chu kì 2, nhóm IIA. |
Câu 16: Có các chất được biểu diễn bằng công thức hóa học sau: Zn, CO2, CaCO3, Br2, K, H2, CuO, Cl2. Số các đơn chất và hợp chất trong các chất trên là:
| A. 2 đơn chất và 6 hợp chất. | B. 5 đơn chất và 3 hợp chất. |
| C. 4 đơn chất và 4 hợp chất. | D. 3 đơn chất và 5 hợp chất. |
Câu 17: Nguyên tử nhôm aluminium (aluminium) có 13 electron ở vỏ. Số electron ở lớp trong cùng của nguyên tử nhôm là
| A. 2. | B. 8. | C. 10. | D. 18. |
Câu 18: Nguyên tử Ba khi nhường đi 2 electron thì tạo thành ion nào?
| A. Ba+. | B. Ba2+. | C. Ba–. | D. Ba2–. |
Câu 19: Cho một số công thức hóa học: MgCl, Ba3(SO4)2, Na2O, KCO3, H3SO4. Số công thức hóa học viết sai là
| A. 2. | B. 4. | C. 3. | D. 5. |
Câu 20: Phát biểu nào sau đây không đúng?
A. Các nguyên tố phi kim tập trung ở các nhóm VA, VIA, VIIA.
B. Các nguyên tố khí hiếm nằm ở nhóm VIIIA.
C. Các nguyên tố kim loại có mặt ở tất cả các nhóm trong bảng tuần hoàn.
D. Các nguyên tố lanthanide và actinide, mỗi họ gồm 14 nguyên tố được xếp riêng thành hai dãy ở cuối bảng.
Câu 21: Phân tử methane gồm 1 nguyên tử carbon liên kết với 4 nguyên tử hydrogen. Khối lượng phân tử methane là
| A. 16 amu. | B. 17 amu. | C. 15 amu. | D. 18 amu. |
Câu 22: Dãy nào sau đây gồm các nguyên tố đều là phi kim?
| A. F, O, Na, N. | B. H, N, O, K. | C. H, О, Cl, Вr. | D. K, Na, Mg, Al. |
Câu 23: Cho công thức hóa học R2O3. Biết khối lượng phân tử của R2O3 là 160. R là nguyên tố hóa học nào sau đây?
| A. Fe. | B. Cu. | C. Al. | D. Zn. |
Câu 24: Cho các chất sau:
(1) Khí nitrogen do nguyên tố N tạo nên.
(2) Khí carbon dioxide do 3 nguyên tố Na, O và H tạo nên.
(3) Sodium hydroxide do 3 nguyên tố Na, O và H tạo nên.
(4) Sulfur do nguyên tố S tạo nên.
Số chất là đơn chất trong những chất trên là
| A. 1. | B. 2. | C. 3. | D. 4. |
Câu 25: Hạt nhân của một nguyên tử potassium có 19 proton 20 neutron. Khối lượng nguyên tử potassium là
| A. 39 amu. | B. 41 amu. | C. 38 amu. | D. 40 amu. |
Câu 26: Hợp chất nào sau đây có phần trăm khối lượng nguyên tố aluminium (Al) là 32,92%?
| A. Al2O3. | B. Al(OH)3. | C. NaAlO2. | D. Al2(SO4)3. |
Câu 27: Khi đốt cháy một chất trong oxygen thu được khí carbon dioxide (CO2) và hơi nước (H2O). Nguyên tố nhất thiết phải có trong thành phần của chất mang đốt là
| A. carbon và hydrogen. | B. carbon và oxygen. |
| C. carbon, hydrogen và oxygen. | D. hydrogen và oxygen. |
Câu 28: Cho công thức phân tử calcium hydroxide: Ca(OH)2.
Nhận định nào sau đây sai?
A. Calcium hydroxide tạo bởi ba nguyên tố Ca, H và O.
B. Calcium hydroxide gồm 1 nguyên tử Ca, 2 nguyên tử O và 2 nguyên tử H.
C. Calcium hydroxide có khối lượng phân tử là 57 amu.
D. Calcium hydroxide là hợp chất.
Câu 29: Khi tạo thành liên kết trong phân tử NaCl, nguyên tử Cl có xu hướng
| A. nhận 1 electron. | B. nhường 1 electron. |
| C. góp chung 1 electron. | D. nhường 7 electron. |
Câu 30: Hợp chất của nguyên tố X với S là X2S3 và hợp chất của nguyên tố Y với H là YH3. Công thức hóa học hợp chất của X với Y là
| A. XY. | B. X2Y. | C. XY2. | D. X2Y. |
Phần II: tự luận (4,0 điểm)
Câu 31 (2 điểm): Hợp chất XY2 là chất góp phần gây nên hiệu ứng nhà kính. Biết rằng:
- Nguyên tử X có tổng số hạt (proton, neutron, electron) là 18 hạt, số hạt mang điện nhiều hơn số hạt không mang điện là 6 hạt.
- Nguyên tử Y có tổng số hạt là 24 hạt, trong hạt nhân nguyên tử Y, số hạt mang điện bằng số hạt không mang điện.
a) Hãy xác định số hạt mỗi loại trong các nguyên tử X, Y và cho biết X và Y là những nguyên tử của nguyên tố hóa học nào.
b) Xác định tên (theo danh pháp IUPAC) và cho biết loại liên kết giữa các nguyên tử trong hợp chất XY2.
Câu 32 (2 điểm): Hợp chất được tạo thành từ nguyên tố M và oxygen có khối lượng phân tử 160 amu. Trong đó, khối lượng của M chiếm 70%. Biết trong hợp chất trên, M có hóa trị III. Hãy xác định nguyên tố A và công thức hóa học của hợp chất.
H = 1 amu; C = 12 amu; N = 14 amu; O = 16 amu; Na = 23 amu; Al = 27 amu; S = 32 amu;
K = 39 amu; Fe = 56 amu; Cu = 64 amu; Zn = 65 amu; Ba = 137 amu
------------HẾT-----------
|
SỞ GIÁO DỤC VÀ ĐÀO TẠO TRƯỜNG THCS………………. |
ĐỀ THI HỌC KÌ II Môn: KHOA HỌC TỰ NHIÊN 7 Thời gian làm bài: … phút (không kể thời gian giao đề) Đề số 2 |
Họ và tên học sinh: …………………………………………… Lớp: 7……..
Phần I: Trắc nghiệm (6,0 điểm)
Câu 1: Trừ hạt nhân của nguyên tử hydrogen, hạt nhân các nguyên tử còn lại được tạo thành từ hạt
| A. electron và proton. | B. electron, proton và neutron. |
| C. neutron và electron. | D. proton và neutron. |
Câu 2: Hiện nay có bao nhiêu chu kì trong bảng tuần hoàn các nguyên tố hóa học?
| A. 6. | B. 7. | C. 8. | D. 9. |
Câu 3: Nguyên tử của các nguyên tố khác khí hiếm có xu hướng tham gia liên kết hóa học để lớp electron ngoài cùng đạt
| A. 5 electron. | B. 6 electron. | C. 7 electron. | D. 8 electron. |
Câu 4: Hóa trị của phosphorus trong hợp chất P2O5 là
| A. II. | B. IV. | C. V. | D. III. |
Câu 5: Lõi dây điện bằng đồng chứa
A. các phân tử Cu2.
B. các nguyên tử Cu riêng rẽ không liên kết với nhau.
C. rất nhiều nguyên tử Cu liên kết với nhau.
D. Một nguyên tử Cu.
Câu 6: Nguyên tố nào sau đây là nguyên tố khí hiếm?
| A. He. | B. Cl. | C. Na. | D. Sr. |
Câu 7: Kí hiệu hóa học được biểu diễn như thế nào?
A. Kí hiệu hóa học được biểu diễn bằng một chữ cái viết in hoa.
B. Kí hiệu hóa học được biểu diễn bằng một hay hai chữ cái đều viết in hoa.
C. Kí hiệu hóa học được biểu diễn bằng một hay hai chữ cái đều viết thường.
D. Kí hiệu hóa học được biểu diễn bằng một hay hai chữ cái, chữ cái đầu tiên viết in hoa và nếu có chữ cái thứ hai thì viết thường.
Câu 8: Nguyên tố calcium có cùng số lớp electron với nguyên tố nào sau đây?
| A. Chlorine. | B. Bromine. | C. Fluorine. | D. Iodine. |
Câu 9: Công thức nào dưới đây viết đúng?
| A. Na2NO3. | B. MgCl2. | C. Ca(OH)3. | D. AlCl2. |
Câu 10: Đây là sơ đồ nguyên tử nguyên tố nào?
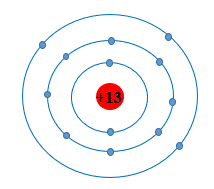
| A. Al. | B. Mg. | C. Na. | D. S. |
Câu 11: Tính chất của oxygen gần giống với tính chất của nguyên tố nào trong các nguyên tố sau đây?
| A. Chlorine. | B. Phosphorus. | C. Nitrogen. | D. Sulfur. |
Câu 12: Liên kết giữa các nguyên tử trong phân tử nước là liên kết
| A. cộng hóa trị. | B. ion. | C. kim loại. | D. phi kim. |
Câu 13: Nguyên tố carbon, nitrogen, phosphorus, potasium có kí hiệu hóa học lần lượt là:
| A. He, N, P, K. | B. C, N, F. K. | C. C, N, P, K. | D. C, N, P, S. |
Câu 14: Trong hạt nhân nguyên tử fluorine có 9 proton. Số electron ở lớp ngoài cùng của vỏ nguyên tử fluorine là
| A. 2. | B. 5. | C. 7. | D. 8. |
Câu 15: Biết rằng phosphoric acid gồm 3 H, 1 P và 4 O. Khối lượng phân tử của phosphoric acid là
| A. 48 amu. | B. 96 amu. | C. 86 amu. | D. 98 amu. |
Câu 16: Nguyên tử O khi nhận thêm 2 electron thì tạo thành ion nào sau đây?
| A. O+. | B. O2+. | C. O–. | D. O2–. |
Câu 17: Nguyên tử X nặng hơn nguyên tử sodium (Na) nhưng nhẹ hơn nhôm (Al). X là
| A. Ca. | B. S. | C. Na. | D. Mg. |
Câu 18: Dãy chất nào sau đây chỉ gồm đơn chất?
| A. H2, Na, O2, N2, Fe. | B. FeCO3, NaCl, H2SO4, H2O. |
| C. NaCl, H2O, H2, N2. | D. CaCO3, NaOH, Fe, H2. |
Câu 19: Nguyên tử sodium có số electron là 11 và neutron là 12. Tổng số hạt trong sodium là
| A. 33. | B. 34. | C. 31. | D. 32. |
Câu 20: Nguyên tố X có số hiệu nguyên tử là 12. Phát biểu nào sau đây là đúng?
A. Điện tích hạt nhân của nguyên tử là 12.
B. X là một kim loại.
C. X là một phi kim.
D. X thuộc chu kì 2, nhóm IIA.
Câu 21: Chất nào sau đây là hợp chất?
A. Khí nitrogen (gồm 2 nguyên tử N).
B. Kim loại copper (gồm 1 nguyên tử Cu).
C. Ethanol (gồm 2 nguyên tử C, 6 nguyên tử H và 1 nguyên tử O).
D. Fluorine (gồm 2 nguyên tử F).
Câu 22: Đốt cháy X trong khí oxygen tạo ra khí carbonic (phân tử gồm C và O), nước (phân tử gồm H và O) và khí nitrogen. Nguyên tố hóa học có thể không có trong thành phần của X là
| A. carbon. | B. oxygen. | C. nitrgen. | D. hydrogen. |
Câu 23: Những nguyên tố hóa học nào sau đây thuộc cùng một chu kì?
| A. Li, Si, Ne. | B. Mg, P, Ar. | C. K, Fe, Ag. | D. B, Al, In. |
Câu 24: Phần trăm khối lượng của Fe trong hợp chất Fe2O3 là
| A. 70%. | B. 50%. | C. 30%. | D. 60%. |
Câu 25: Cho các phát biểu sau:
(a) Potassium hydroxide (NaOH) gồm 2 nguyên tố là potasium và oxygen.
(b) Sodium chloride (NaCl) do nguyên tố sodium và nguyên tố chlorine tạo nên.
(c) Khí carbon dioxide (CO2) gồm 2 đơn chất carbon và oxygen.
(d) Hydrochloric acid (HCl) gồm 2 chất là hydrogen và chlorine.
Số phát biểu sai là
| A. 1. | B. 2. | C. 3. | D. 4. |
Câu 26: Một nguyên tử X có tổng số hạt là 115, X có tỉ lệ số hạt mang điện và số hạt không mang điện là 14/9. Số hạt không mang điện là
| A. 80. | B. 90. | C. 35. | D. 45. |
Câu 27: Nguyên tố A thuộc chu kì 2, nhóm IVA. Điện tích hạt nhân nguyên tử nguyên tố X là
| A. +4. | B. +7. | C. +6. | D. +5. |
Câu 28: Tổng số hạt trong nguyên tử M là 21. Nguyên tử M có tổng số hạt mang điện gấp đôi số hạt không mang điện. Vị trí và tính chất cơ bản của nguyên tố M trong bảng tuần hoàn là
A. thuộc chu kì 2, nhóm VA, là kim loại.
B. thuộc chu kì 2, nhóm VA, là phi kim.
C. thuộc chu kì 3, nhóm VA, là kim loại.
D. thuộc chu kì 3, nhóm VA, là phi kim.
Câu 29: Hợp chất A có dạng XO2. Biết A nặng hơn phân tử khí hydrogen 32 lần. Công thức phân tử của A là
| A. CO2. | B. SiO2. | C. NO2. | D. SO2. |
Câu 30: Hợp chất của ngyên tố X với nhóm PO4 hóa trị III là XPO4. Hợp chất của nguyên tố X với H là H3Y. Vậy hợp chất của X với Y có công thức là
| A. X2Y3. | B. X2Y. | C. XY2. | D. XY. |
Phần II: tự luận (4,0 điểm)
Câu 31 (2 điểm): Tổng số hạt mang điện trong hợp chất AB là 56. Số hạt mang điện trong hạt nhân nguyên tử A ít hơn số hạt mang điện trong hạt nhân nguyên tử B là 6 hạt.
a) Xác định công thức hóa học của hợp chất AB.
b) Xác định loại liên kết hóa học trong phân tử AB.
Câu 32 (2 điểm): Cho biết hợp chất của nguyên tố R (hóa trị x) với nhóm SO4 có 20% khối lượng thuộc nguyên tố R.
a) Thiết lập biểu thức tính khối lượng nguyên tử R theo hóa trị x.
b) Hãy tính % khối lượng của nguyên tố R đó trong hợp chất của nguyên tố R với oxygen (không cần xác định nguyên tố R).
Cho biết:
H = 1 amu; N = 14 amu; O = 16 amu; Na = 23 amu ; Mg = 24 amu; Al = 27 amu; Si = 28 amu ; P = 31 amu; S = 32 amu; K = 39 amu; Ca = 40; Fe = 56 amu; Cu = 64 amu; Zn = 65 amu; Ba = 137 amu
------------HẾT-----------
Đề thi cuối kì 2 KHTN 7 phân môn Hóa sách Kết nối tri thức Nâng cao Đề 3
Đề thi cuối kì 2 KHTN 7 phân môn Hóa sách Kết nối tri thức Nâng cao Đề 4
Đề thi cuối kì 2 KHTN 7 phân môn Hóa sách Kết nối tri thức Nâng cao Đề 5
Mời các bạn xem chi tiết các đề kèm đáp án hướng dẫn giải chi tiết trong FILE TẢI VỀ







