Hạt mang điện âm trong nguyên tử là
Trong nguyên tử, proton mang điện tích dương, electron mang điện tích âm và neutron không mang điện tích.
Hạt mang điện âm trong nguyên tử là
Trong nguyên tử, proton mang điện tích dương, electron mang điện tích âm và neutron không mang điện tích.
Chọn phát biểu đúng về electron.
Một electron có khối lượng nhỏ hơn một proton và mang điện tích âm.
Tổng số hạt trong hạt nhân của nguyên tử A là 24 hạt, trong đó số hạt không mang điện là 12. Tính số electron của nguyên tử A?
Theo đề, tổng số hạt trong hạt nhân của nguyên tử A là 24, hạt không mang điện là n = 12
⇒ p = 24 – n = 12
Trong nguyên tử: số hạt p = e = 12
Vậy số hạt electron của nguyên tử A là 12.
Nguyên tử oxygen có 8 proton nên oxygen có
Nguyên tử oxygen có 8 proton nên oxygen có điện tích hạt nhân là +8, số đơn vị điện tích hạt nhân là 8.
Số electron tối đa ở lớp thứ nhất là
Số electron tối đa ở lớp thứ nhất là 2.
Vì sao có thể coi khối lượng nguyên tử bằng khối lượng hạt nhân?
Khối lượng của một nguyên tử bằng tổng khối lượng của proton, neutron và electron trong nguyên tử đó.
Proton và neutron đều có khối lượng xấp xỉ bằng 1 amu. Khối lượng của electron là 0,00055 amu, nhỏ hơn nhiều lần so với khối lượng của proton và neutron nên có thể coi khối lượng nguyên tử bằng khối lượng hạt nhân.
Nguyên tử X có tổng số hạt cơ bản là 82. Hạt mang điện nhiều hơn số hạt không mang điện là 22. Số proton là:
Nguyên tử X có tổng số hạt cơ bản là 82:
⇒ P + N + E = 82 hay 2P + N = 82 (1)
Hạt mang điện nhiều hơn số hạt không mang điện là 22:
⇒ P + E – N = 22 ⇒ 2P – N = 22 (2)
Giải (1) và (2) ta có P = 26, N = 30
Cho mô hình cấu tạo nguyên tử magnesium:
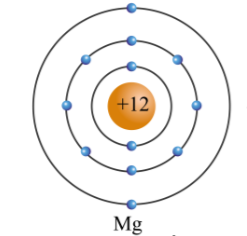
Nguyên tử magnesium có bao nhiêu lớp electron và có bao nhiêu electron ở lớp ngoài cùng?
Nguyên tử magnesium có 3 lớp electron.
- Lớp thứ nhất có 2 electron.
- Lớp thứ hai có 6 electron.
- Lớp thứ 3 (lớp ngoài cùng) có 2 electron.
Theo mô hình của Rơ-dơ-pho – Bo, trong nguyên tử, các electron chuyển động như thế nào?
Theo mô hình của Rơ-dơ-pho – Bo, trong nguyên tử, các electron chuyển động trên những quỹ đạo xác định xung quanh hạt nhân, như các hành tinh quay quanh Mặt Trời.
Nguyên tử sodium có 11 proton và 12 neutron. Khối lượng nguyên tử sodium là
Proton và neutron đều có khối lượng xấp xỉ bằng 1 amu.
Khối lượng nguyên tử sodium là: 11.1 + 12.1 = 23 (amu).
Chú ý: Một cách gần đúng, coi khối lượng nguyên tử xấp xỉ khối lượng của hạt nhân nguyên tử.
Tính số phát biểu đúng trong các phát biểu sau:
a) Các hạt electron được tìm thấy trong hạt nhân của nguyên tử.
b) Các hạt neutron và electron hút nhau.
c) Trong nguyên tử, số electron tối đa ở lớp electron thứ hai là 8.
d) Phần lớn khối lượng của nguyên tử tập trung ở hạt nhân nên kích thước của hạt nhân gần bằng kích thước của nguyên tử.
a. Sai. Các hạt electron được tìm thấy ở lớp vỏ nguyên tử.
b. Sai. Neutron không mang điện tích và electron mang điện tích âm ⇒ chúng không hút nhau do không mang điện tích trái dấu.
c. Đúng.
d. Sai. Phần lớn khối lượng của nguyên tử tập trung ở hạt nhân nên khối lượng của hạt nhân gần bằng khối lượng của nguyên tử.
Hầu hết các nguyên tử được cấu tạo từ những hạt là
Nguyên tử được coi như một quả cầu, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Vỏ nguyên tử được tạo bởi một hay nhiều electron chuyển động xung quanh hạt nhân.
Hạt nhân nguyên tử được tạo bởi các proton và neutron.
⇒ Nguyên tử được cấu tạo từ những hạt là proton, electron và neutron.
