Trong liên kết cộng hóa trị, các electron chung giữa hai nguyên tử được hình thành từ
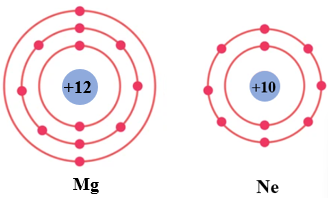
Các nguyên tử liên kết với nhau để tạo ra lớp electron ngoài cùng bền vững tương tự khí hiếm (với 8 electron).
Khi tạo thành liên kết cộng hóa trị, các electron góp chung được lấy từ lớp electron ngoài cùng của nguyên tử với số lượng thích hợp để tổng số electron lớp ngoài cùng (kể cả electron chung và riêng) của các nguyên tử là 8 electron (riêng H là 2 electron tương tự He).