Chất nào sau đây khi phản ứng với dung dịch hỗn hợp HCl và HNO2 ở 0 – 5oC tạo ra muối diazonium?
Aniline khi phản ứng với dung dịch hỗn hợp HCl và HNO2 ở 0 – 5oC tạo ra muối diazonium.
C6H5NH2 + HONO + HCl [C6H5N2]+Cl– + 2H2O
Chất nào sau đây khi phản ứng với dung dịch hỗn hợp HCl và HNO2 ở 0 – 5oC tạo ra muối diazonium?
Aniline khi phản ứng với dung dịch hỗn hợp HCl và HNO2 ở 0 – 5oC tạo ra muối diazonium.
C6H5NH2 + HONO + HCl [C6H5N2]+Cl– + 2H2O
Cho 0,76 gam hỗn hợp X gồm hai amine đơn chức, có số mol bằng nhau, phản ứng hoàn toàn với dung dịch HCl dư, thu được 1,49 gam muối. Khối lượng của amin có phân tử khối nhỏ hơn trong 0,76 gam X là
Gọi công thức phân tử trung bình của 2 amin là NH2.
Bảo toàn khối lượng:
mX + mHCl = mmuối ⇒ mHCl = 1,49 – 0,76 = 0,73 gam
⇒ nHCl = 0,02 mol
Vì amine đơn chức nên namine = nHCl = 0,02 mol
⇒ NH2 =
= 38
⇒ = 22 → có 1 amine là CH3NH2.
Vì số mol 2 amine bằng nhau ⇒ nCH3NH2 = 0,01 mol ⇒ m = 0,31 gam
Hỗn hợp 1,07 gam hai amine đơn chức bậc nhất kế tiếp nhau trong dãy đồng đẳng phản ứng vừa hết với nitrous acid ở nhiệt độ thường tạo nên dung dịch X. Cho X phản ứng với Na dư thu được 0,015 mol H2. Công thức 2 amine là
Đặt công thức trung bình của 2 amine là .
Sơ đồ phản ứng:
Theo sơ đồ ta thấy số mol 2 amine là 0,03 mol.
Chất có tính base mạnh nhất là
Thứ tự tăng dần tính base là: arylamine < NH3 < alkylamine.
Amine bậc 2 có tính base mạnh hơn amine bậc 1.
⇒ Chất có tính base mạnh nhất là (CH3)2NH.
Trong các chất dưới đây, chất nào là amine bậc hai?
Bậc của amine được tính bằng số nguyên tử H trong phân tử ammonia bị thay thế bởi gốc hydrocarbon, do vậy chỉ có CH3NHCH3 là amine bậc hai.
Ở điều kiện thường, amine nào sau đây ở trạng thái lỏng?
Aniline là chất lỏng ở điều kiện thường.
Biết rằng mùi tanh của cá (đặc biệt cá mè) là hỗn hợp các amine (nhiều nhất là trimethylamine) và một số chất khác. Để khử mùi tanh của cá trước khi nấu ta có thể dùng dung dịch nào sau đây?
Để khử mùi tanh của cá trước khi nấu ta có thể rửa cá sau khi mổ với giấm ăn pha loãng hoặc nước chanh pha loãng…
Cho aniline tác dụng vừa đủ với dung dịch HCl thu được 38,85 gam muối. Khối lượng aniline đã phản ứng là
nC6H5NH3Cl = = 0,3 mol
C6H5NH2 + HCl → C6H5NH3Cl
mol: 0,3 ← 0,3
⇒ mC6H5NH2 = 0,3.93 = 27,9 gam
Cho các chất có công thức cấu tạo sau:
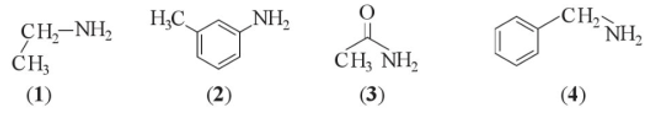
Số chất thuộc loại arylamin là
Arylamine (hay amine thơm) có nguyên tử nitrogen liên kết trực tiếp với nguyên tử carbon của vòng benzene.
→ Chỉ có chất (2) là aryl amine.
Cho aniline vào ống nghiệm chứa nước và lắc đều. Sau đó thêm lần lượt dung dịch HCl, rồi dung dịch NaOH dư vào ống nghiệm và để yên một lúc, hiện tượng quan sát được trong ống nghiệm là:
- Khi cho aniline vào nước ta thấy dung dịch bị đục do aniline ít tan trong nước.
- Khi thêm dung dịch HCl vào ta thấy dung dịch trong suốt do có phản ứng tạo muối tan tốt trong nước.
Phương trình phản ứng:
C6H5NH2 + HCl → C6H5NH3Cl.
- Tiếp tục thêm NaOH dư vào dung dịch thu được ta thấy hiện tượng phân lớp do sản phẩm tạo ra chứa C6H5NH2 ít tan trong nước.
Phương trình phản ứng:
C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O.
Vậy hiện tượng quan sát được là ban đầu dung dịch bị đục, sau đó trong suốt, rồi phân lớp.
Theo danh pháp gốc – chức, tên gọi của hợp chất CH3CH2NHCH3 là
Theo danh pháp gốc – chức, tên gọi của hợp chất CH3CH2NHCH3 là ethylmethylamine.
Cho các dung dịch riêng biệt sau: CH3NH2, (CH3)2NH, (CH3)3N, C6H5NH2. Số dung dịch làm xanh giấy quỳ tím là
Dung dịch aniline trong nước không làm đổi màu quỳ tím, trong khi dung dịch các alkylamine có thể làm quỳ tím hóa xanh.
→ Các dung dịch làm xanh giấy quỳ tím là: CH3NH2, (CH3)2NH, (CH3)3N.
Có bao nhiêu amine bậc ba là đồng phân cấu tạo của nhau ứng với công thức phân tử C5H13N?
Đồng phân bậc III:
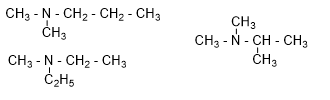
→ có 3 đồng phân bậc III.
Chất phản ứng với dung dịch FeCl3 cho kết tủa là:
Các amine có khối lượng phân tử nhỏ có khả năng tác dụng với dung dịch muối của một số kim loại tạo thành kết tủa hydroxide.
3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3[CH3NH3]+Cl–
Cho 9,3 gam một alkylamine X tác dụng với dung dịch FeCl3 dư thu được 10,7 gam kết tủa. Công thức cấu tạo của X là
nFe(OH)3 = = 0,1 (mol)
Gọi công thức của alkylamine là: CnH2n+1NH2
3CnH2n+1NH2 + FeCl3 + 3H2O → 3CnH2n+1NH3Cl + Fe(OH)3↓
mol: 0,3 ← 0,1
⇒ MCnH2n+1NH2 = = 31 (g/mol)
⇒ 14n + 17 = 31
⇒ n = 1
Vậy công thức của X là CH3NH2.
Có 3 chất lỏng: benzene, aniline, styrene đựng riêng biệt trong 3 lọ mất nhãn. Thuốc thử để phân biệt 3 chất lỏng trên là
- Có thể dùng nước bromine để phân biệt 3 chất lỏng: benzene, aniline, styrene.
- Hiện tượng:
Xuất hiện kết tủa trắng ⇒ aniline.
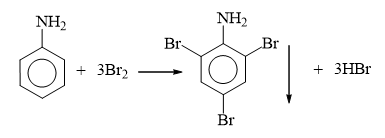
Làm mất màu dung dịch bromine ⇒ styrene.
C6H5–CH=CH2 + Br2 ⟶ C6H5–CHBr–CH2Br
Không hiện tượng ⇒ Benzene.
Cho dung dịch methylamine cho đến dư lần lượt vào từng ống nghiệm đựng các dung dịch AlCl3, FeCl3, Zn(NO3)2, Cu(NO3)2, HCl. Số chất kết tủa còn lại là:
Cho methylamine vào các dung dịch → ban đầu thu được các kết tủa: Al(OH)3, Fe(OH)3, Zn(OH)2, Cu(OH)2.
Vì Zn(OH)2 và Cu(OH)2 tạo phức với amine → kết tủa còn lại thu được là Al(OH)3 và Fe(OH)3.
Dãy gồm tất cả các amine là:
Khi thay thế một hay nhiều nguyên tử hydrogen trong phân tử NH3 bằng một hay nhiều gốc hydrocarbon ta thu được amine.
⇒ Dãy gồm tất cả các amine là: C2H5NH2, (CH3)3N, CH3NH2, C6H5NH2.
Nguyên nhân amine có tính base là
Nguyên nhân amine có tính base là do nguyên tử N trong phân tử amine có cặp electron hóa trị riêng.
Cho 15 gam hỗn hợp X gồm các amin: aniline, methylamine, dimethylamine, diethylmethylamine tác dụng vừa đủ với 50 ml dung dịch HCl 1M. Khối lượng sản phẩm thu được có giá trị là
Áp dụng định luật bảo toàn khối lượng:
mmuối = mamine + mHCl = 15 + 0,05.36,5 = 16,825 gam
