Dung dịch nào sau đây tác dụng được với kim loại Cu?
Dung dịch HNO3 có tính oxi hóa mạnh nên nó có thể oxi hóa được hầu hết các kim loại (trừ Au, Pt) lên số oxi hóa cao nhất.
Dung dịch nào sau đây tác dụng được với kim loại Cu?
Dung dịch HNO3 có tính oxi hóa mạnh nên nó có thể oxi hóa được hầu hết các kim loại (trừ Au, Pt) lên số oxi hóa cao nhất.
Kim loại Na tác dụng với nước sinh H2 và
Kim loại Na tác dụng với nước sinh H2 và:
2Na + 2H2O → 2NaOH + H2
Kim loại Fe tác dụng với dung dịch nào sau đây sinh ra khí H2?
Kim loại sắt có giá trị thế điện cực chuẩn EoMn+/M < 0 có thể khử được H+ trong dung dịch hydrochloric acid hoặc dung dịch sulfuric acid loãng, tạo thành khí H2.
Fe + 2HCl → FeCl2 + H2↑
Kim loại bị thụ động trong sulfuric acid đặc, nguội là:
Do sulfuric acid đặc, nguội đã oxi hóa bề mặt kim loại tạo thành màng oxide có tính trơ, làm cho một số kim loại như nhôm, sắt, chromium bị thụ động.
Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 8,6765 lít SO2 (đkc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là:
nSO2 = 0,35 (mol)
Gọi nCu = y, nFe = x mol
| Quá trình nhường electron | Quá trình nhận electron |
mol: x → 3x mol: y → 2y | mol: 0,7 ← 0,35 |
Áp dụng định luật bảo toàn electron ta có:
3x + 2y = 0,7 (1)
Khối lượng hai kim loại = 1,84 g:
56x + 64y = 184 (2)
Giải (1) và (2) ta có: x = 0,1, y = 0,2 (mol)
% mFe = .100 % = 30,43%
Dung dịch muối ZnSO4 có lẫn một ít tạp chất là CuSO4. Dùng kim loại nào sau đây để làm sạch dung dịch ZnSO4 nêu trên là dễ dàng nhất?
Ta dùng kim loại Zn để làm sạch:
Zn + CuSO4 → ZnSO4 + Cu↓
Kim loại nào sau đây không tác dụng với dd H2SO4 loãng và dung dịch HCl?
Kim loại Cu có giá trị thế điện cực chuẩn dương nên không tác dụng với dung dịch hydrochloric acid hoặc sulfuric acid loãng.
Dãy kim loại tác dụng được với H2O ở nhiệt độ thường là
Cặp oxi hóa khử Mn+/M có giá trị thế điện cực chuẩn nhỏ hơn –0,413 V thì kim loại M có thể tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen.
→ Dãy kim loại tác dụng được với H2O ở nhiệt độ thường là: K, Na, Ca, Ba.
Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10%, thu được 2,479 lít khí H2 (ở đkc). Khối lượng dung dịch thu được sau phản ứng là
nH2 = 0,1 mol
Bảo toàn nguyên tố H: nH2 = nH2SO4 = 0,1 mol
⇒ mH2SO4 = 0,1.98 = 9,8 gam
⇒ mdung dịch H2SO4 = = 98 gam
⇒ mdung dịch sau phản ứng = mkim loại + mdung dịch H2SO4 – mH2
= 3,68 + 98 – 0,1.2 = 101,48 gam
Cho các kim loại sau: Li, Mg, Al, Zn, Fe, Ni. Có bao nhiêu kim loại tác dụng với HCl và Cl2 thu được cùng một muối?
Các kim loại tác dụng với HCl và Cl2 cho cùng một muối là: Li; Mg; Al; Zn; Ni.
Sắt là kim loại có nhiều hóa trị. Khi phản ứng với HCl cho muối iron(II), khi phản ứng với Cl2 cho muối iron(III).
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 2FeCl3
Ngâm một đinh sắt trong 100 ml dung dịch CuCl2 1 M, giả thiết Cu tạo ra bám hết vào đinh sắt. Sau khi phản ứng xong lấy đinh sắt ra, sấy khô, khối lượng đinh sắt tăng thêm
nCuCl2 = 0,1 mol
Phương trình hóa học
Fe + CuCl2 → FeCl2 + Cu
⇒ nFe pư = nCu = 0,1 mol
Δmtăng = mCu – mFe pư = 0,1.64 – 0,1.56 = 0,8 gam
Cho 0,87 gam hỗn hợp gồm Fe, Cu, Al vào bình đựng 300 ml dung dịch H2SO4 0,1 M. Sau khi các phản ứng xảy ra hoàn toàn thu được 0,32 gam chất rắn và có 495,8 ml khí (đkc) thoát ra. Thêm tiếp vào bình 0,425 gam NaNO3 khi các phản ứng kết thúc thì thể tích khí NO (đkc, sản phẩm khử duy nhất) tạo thành và khối lượng muối trong dung dịch là
nH2SO4 = 0,03 mol và nH2 = 0,02 ⇒ acid dư, Al và Fe tan hết.
⇒ Chất rắn còn lại là Cu: nCu = = 0,005 (mol)
Ta có: 27nAl + 56nFe = 0,87 – 0,32 = 0,55 (1)
Bảo toàn electron: 3nAl + 2nFe = 2nH2 = 0,04 (2)
Giải hệ (1) và (2) ta có: nAl = 0,01 mol và nFe = 0,005 mol
Trong bình chứa Al3+ (0,01 mol); Fe2+ (0,005 mol), H+ (0,02 mol), SO42- (0,03 mol) và Cu (0,005 mol).
Khi thêm vào bình: nNaNO3 = 0,005 (mol)
Quá trình nhận electron của chất oxi hóa:
4H+ + NO3– + 3e → NO + 2H2O
mol: 0,02 → 0,005 → 0,015 → 0,005
Chất khử: ne cho = nFe2+ + 2nCu = 0,015 (mol)
Vậy cả H+ và NO3– đều hết; Fe2+ và Cu phản ứng hết tạo ra Fe3+ và Cu2+.
⇒ VNO = 0,005.24,79 = 0,12395 lít
Trong dung dịch chứa Al3+, Fe3+, Cu2+ (tổng 0,87 gam); Na+ (0,005 mol); SO42- (0,03 mol).
⇒ mmuối = 3,865 gam
Kim loại nào sau đây có tính khử yếu nhất?
Ta có:
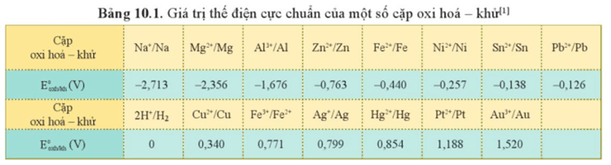
Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu.
→ Kim loại có tính khử yếu nhất trong các kim loại trên là Ag.
Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3 M thu được 21,9 gam hỗn hợp chất rắn gồm 2 kim loại. Giá trị của a là
2 kim loại sau phản ứng là Cu và Al ⇒ Mg hết, CuSO4 hết, Al2(SO4)3 dư.
⇒ nCu = nCuSO4 = 0,3 mol
⇒ mAl = 21,9 – 0,3.64 = 2,7 gam
⇒ nAl = 0,1 mol
Mg + Cu2+ → Mg2+ + Cu
mol: 0,3 ← 0,3
3Mg + 2Al3+ → 3Mg2+ + 2Al
mol: 0,15 ← 0,1
⇒ mMg = 0,45.24 = 10,8 gam
Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, Cu(NO3)2, AgNO3, MgCl2. Số trường hợp xảy ra phản ứng hóa học là
Fe + 2FeCl3 → 3FeCl2
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
→ Có 3 trường hợp xảy ra phản ứng hóa học.
Tính chất hóa học đặc trưng của kim loại là
Tính chất hóa học đặc trưng của kim loại là tính khử.
Đốt cháy hoàn toàn m gam Fe trong khí S dư, thu được 8,8 gam FeS. Giá trị của m là
nFeS = = 0,1 (mol)
Fe + S FeS
mol: 0,1 ← 0,1
⇒ mFeS = 0,1.56 = 5,6 (g)
Hoà tan 19,2 gam kim loại M trong H2SO4 đặc nóng dư, thu được khí SO2. Cho khí này hấp thụ hoàn toàn trong NaOH dư, sau phản ứng đem cô cạn dung dịch thu được 37,8 gam chất rắn. M là kim loại
nNa2SO3 = 0,3 (mol)
Do NaOH dư nên có phản ứng sau phản ứng chỉ thu được muối trung hòa:
2NaOH + SO2 → Na2SO3 + H2O
mol: 0,3 ← 0,3
Gọi hóa trị của M là x.
Bảo toàn electron ta có:
nM.x = nSO2.2 ⇒ nM =
MM = 32x, Với x = 2, M = 64 (Cu)
Để oxi hóa hoàn toàn một kim loại R thành oxide phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. R là kim loại nào sau đây ?
Gọi nguyên tử khối của kim loại R là R và có hóa trị là x (x = 1, 2, 3, 4).
4R + xO2 2R2Ox
Theo đề bài ta có:
Ta có bảng sau:
| n | 1 | 2 | 3 |
| M | 20 (loại) | 40 (thỏa mãn) | 60 (loại) |
Vậy kim loại M là Ca.
Hiện tượng xảy ra khi đốt sắt trong bình khí chlorine là
Hiện tượng xảy ra khi đốt sắt trong bình khí chlorine là có khói màu nâu đỏ tạo thành:
2Fe + 3Cl2 2FeCl3
