Cho sơ đồ phản ứng:
NiCl2(s) + A ⟶ [Ni(OH2)6]2+(aq) + B
A và B lần lượt là:
A và B lần lượt là: H2O, Cl–.
NiCl2(s) + H2O ⟶ [Ni(OH2)6]2+(aq) + Cl–
Cho sơ đồ phản ứng:
NiCl2(s) + A ⟶ [Ni(OH2)6]2+(aq) + B
A và B lần lượt là:
A và B lần lượt là: H2O, Cl–.
NiCl2(s) + H2O ⟶ [Ni(OH2)6]2+(aq) + Cl–
Nhỏ từ từ dung dịch NH3 vào AgCl thu được phức chất [Ag(NH3)2]+. Dấu hiệu chứng tỏ phản ứng tạo phức chất [Ag(NH3)2]+ tạo ra là:
Dấu hiệu chứng tỏ có phản ứng tạo phức chất: Kết tủa tan dần thu được dung dịch trong suốt.
Hợp chất nào được tạo thành khi dung dịch ammoniac lấy dư tương tác với dung dịch CuSO4?
Ban đầu:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 + (NH4)2SO4
Khi NH3 đạt dư:
CuSO4 + 4NH3 → [Cu(NH3)4]SO4
Hemoglobin trong máu gồm ion M2+ liên kết với prophyrin và một phân tử protein có tên globin tạo thành phức chất bát diện, phức này có nhiệm vụ vận chuyển oxygen từ phổi đến các mô và CO2 từ các mô về phổi. M là kim loại nào?
M là kim loại Fe:
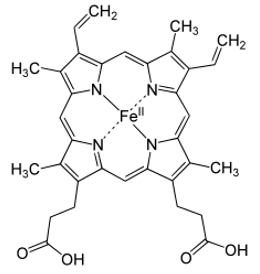
Vàng (Au) tồn tại trong thiên nhiên dưới dạng tự do nhưng quặng vàng thường rất nghèo. Người ta nghiền quặng trộn vào dung dịch KCN và sục khí O2 liên tục, vàng sẽ bị hòa tan thành phức chất, sau đó dùng kim loại X để đẩy vàng (Au) ra khỏi hợp chất. Kim loại X là
Theo quá trình trên:
4Au + 8KCN + O2 + 2H2O → 4K[Au(CN)2] + 4KOH
Sau đó dùng bột Zn đẩy Au ra khỏi hợp chất:
Zn + 2K[Au(CN)2] → K2[Zn(CN)4] + 2Au
Trong phản ứng: [Cu(OH2)6(aq) + 4Cl–(aq) → [CuCl4]2–(aq) + 6H2O(l). Phối tử bị thay thế là
Trong phản ứng trên, phối tử H2O bị thay thế bởi phối tử Cl–.
Phức chất aqua có dạng hình học bát diện được hình thành khi cho CrCl3 vào nước là:
Phức chất aqua có dạng hình học bát diện được hình thành khi cho CrCl3 vào nước tức là nguyên tử trung tâm Cr3+ tạo 6 liên kết σ với 6 phân tử nước.
Phương trình hoá học của quá trình tạo phức khi cho CrCl3 vào nước:
CrCl3(aq) + 6H2O(l) ⟶ [Cr(OH2)6]Cl3(aq)
Hay Cr3+(aq) + 6H2O(l) ⟶ [Cr(OH2)6]3+(aq)
Ứng dụng nào sau đây của phức chất dựa vào phản ứng tạo phức chất?
Ứng dụng của phức chất dựa vào phản ứng tạo phức chất là:
- Xác định hàm lượng cation kim loại chuyển tiếp trong dung dịch.
- Hấp thụ và loại bỏ các cation kim loại nặng, độc ra khỏi cơ thể ở dạng phức chất.
So với phức chất ban đầu, sự thay thế phối tử thường tạo thành phức chất mới
Sự thay thế phối tử thường tạo thành phức chất mới bền hơn so với phức ban đầu.
Cho V (l) NH3 1 M vào 100 ml dung dịch CuSO4 0,3 M thu được 1,96 gam kết tủa. Giá trị của V là
2NH3 + CuSO4 → Cu(OH)2 + (NH4)SO4
mol: 0,06 ← 0,03 → 0,03
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (Cu(OH)2 dư 0,02 mol)
mol: 0,01 → 0,04
⇒ nNH3 (max) = 0,1 ⇒ V = 0,1 (l).
Trong các phức chất aqua của cation kim loại chuyển tiếp, phối tử là:
Trong các phức chất aqua của cation kim loại chuyển tiếp, phối tử là các phân tử H2O.
Chọn câu sai.
Các phản ứng tạo phức chất thường có một số dấu hiệu dễ quan sát như sự biến đổi
Các phản ứng tạo phức chất thường có một số dấu hiệu dễ quan sát như sự biến đổi màu sắc, sự hòa tan, sự kết tủa.
Xét phản ứng sau:
[PtCl4]2- + 2NH3 → [PtCl2(NH3)2] + 2Cl−
Hãy cho biết trong phản ứng trên có bao nhiêu phối tử Cl− trong phức chất [PtCl4]2- đã bị thế bởi phối tử NH3.
Dựa vào phương trình hoá học thấy có 2 phối tử Cl− trong phức chất [PtCl4]2– đã bị thế bởi phối tử NH3.
Nhỏ từ từ NaOH đến dư vào dung dịch ZnSO4 thu được phức chất là:
2NaOH + ZnSO4 → Na2SO4 + Zn(OH)2
2NaOH + Zn(OH)2 → Na2[Zn(OH)4]
Trong dung dịch, ion Fe2+ tạo thành phức chất aqua có dạng hình học bát diện. Công thức hoá học của phức chất là
Công thức hoá học của phức chất: [Fe(H2O)6]2+.
Phức nào sau đây không phải là phức aqua của kim loại chuyển tiếp:
Công thức tổng quát của phức chất aqua của Mn+ là: [M(OH2)m]n+.
→ [Zn(OH)4]2– không phải phức aqua.
Nhỏ từ từ dung dịch NH3 vào dung dịch CuSO4 cho tới dư. Hiện tượng quan sát được là
Nhỏ từ từ dung dịch NH3 vào dung dịch CuSO4 cho tới dư:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2↓ + (NH4)2SO4
Cu(OH)2↓ + 4NH3 → [Cu(NH3)4](OH)2
→ Hiện tượng quan sát được là xuất hiện ↓ màu xanh nhạt, lượng ↓ tăng dần đến không đổi. Sau đó ↓ giảm dần cho tới khi tan hết thành dung dịch màu xanh đậm.
Công thức tổng quát của phức chất aqua của Mn+ là
Công thức tổng quát của phức chất aqua của Mn+ là [M(OH2)m]n+.
Phản ứng nào dưới đây là phản ứng thay thế phối tử trong phức chất?
a) [Co(OH2)6]3+(aq) + 6NH3(aq) ⟶ [Co(NH3)6]3+(aq) + 6H2O(l)
b) 2Na[Au(CN)2](aq) + Zn(s) ⟶ Na2[Zn(CN)4](aq) + 2Au(s)
c) [Co(OH2)6]2+(aq) + 4Cl−(aq) ⇌ [CoCl4]2−(aq) + 6H2O(l)
Phản ứng thay thế phối tử trong phức chất là:
a) Phối tử NH3 thay thế cho phối tử H2O trong phức chất.
c) Phối tử Cl− thay thế cho phối tử H2O trong phức chất.
Còn phản ứng b là phản ứng thay thế nguyên tử trung tâm Au bằng Zn.
Cho phản ứng thuận nghịch dưới đây:
[Cu(OH2)6]2+(aq) + 4Cl−(aq) ⇌ [CuCl4]2−(aq) + 6H2O(l)
Màu xanh Màu vàng
Cách làm nào sau đây làm màu vàng của dung dịch đậm hơn?
Để màu vàng của dung dịch đậm hơn thì phản ứng cần chuyển dịch theo chiều thuận.
Giảm nồng độ [Cu(OH2)6]2+ → Cân bằng chuyển dịch theo chiều nghịch.
Giảm nồng độ Cl− → Cân bằng chuyển dịch theo chiều nghịch.
Tăng nồng độ Cl− → Cân bằng chuyển dịch theo chiều thuận.
Thêm [CuCl4]2− vào dung dịch → Cân bằng chuyển dịch theo chiều nghịch.
