Chọn phát biểu đúng
Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
Chọn phát biểu đúng
Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
Nhận định nào sau đây không đúng về tính chất vật lí của amine
Tính chất vật lí:
Amine có nhiệt độ sôi cao hơn hydrocarbon có cùng số nguyên tử carbon hoặc có phân tử khối tương đương.
Methylamine, ethylamine, dimethylamine và trimethylamine là những chất khí, có mùi tanh của cá hoặc mùi khai tương tự ammonia (tuỳ nồng độ)
Ở điều kiện thường, aniline là chất lỏng, ít tan trong nước.
Khi cho aniline vào ống nghiệm chứa nước, hiện tượng quan sát được là:
Ở điều kiện thường, aniline là chất lỏng, ít tan trong nước. Có nhiệt độ sôi là 184,1oC, nhiệt độ nóng chảy -6,0oC.
Khi cho aniline vào ống nghiệm chứa nước, hiện tượng quan sát được là Aniline ít tan trong nước tạo dung dịch bị đục, để lâu có sự tách lớp
Trong các chất dưới đây, chất nào là amine bậc hai?
Bậc của amine được tính bằng số gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen.
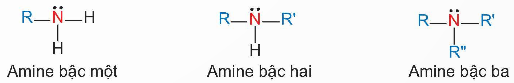
CH3NHCH3 là amine bậc hai
Số đồng phân amine ứng với công thức C3H9N là:
Bậc 1 có: CH3-CH2-CH2-NH2
CH3-CH(NH2)-CH3
Bậc 2 có: CH3-NH-CH2-CH3
Bậc 3 có: (CH3)3N
Tên gọi của amine có công thức cấu tạo CH3–NH–CH2–CH3 là
Tên của amine được gọi theo danh pháp gốc chức và danh pháp thay thế:
Theo danh pháp gốc chức:
CH3CH2NHCH3: Ethylmethylamine
Danh pháp thay thế
CH3CH2NHCH3: N-methylethanamine
Công thức cấu tạo của ethylamine là
Công thức cấu tạo của ethylamine CH3CH2NH2
Trimethylamine là chất chủ yếu gây nên mùi tanh của cá, đặc biệt là cá mè. Tính chất, đặc điểm nào sau đây là sai về Trimethylamine?
Trimethylamine (CH3)3N Là amine bậc ba
Ở điều kiện thường là chất khí
Danh pháp thay thế: N,N-dimethylmethanamine
Có công thức phân tử là C3H9N
Hiện tượng sau khi kết thúc phản ứng hóa học khi cho dung dịch HCl dư vào aniline là
Dung dịch tạo thành đồng nhất trong suốt khi cho dung dịch HCl dư vào aniline
Cho vài giọt nước bromine vào dung dịch aniline, lắc nhẹ thấy xuất hiện
Khi nhỏ vài giọt aniline vào ống nghiệm chứa nước bromine thì kết tủa trắng xuất hiện.
C6H5NH2 + 3Br2 C6H2Br3 ↓ (trắng) + 3HBr
Methylamine phản ứng được với dung dịch
Methylamine phản ứng với hydrochloric acid.
CH3NH2 + HCl → CH3NH3Cl
Cho vài giọt phenolphthalein vào dung dịch ethylamine thì dung dịch chuyển thành:
Cho vài giọt phenolphthalein vào dung dịch ethylamine thì dung dịch chuyển thành màu hồng
Biết mùi tanh của cá thường do trimethylamine gây ra và một số chất khác gây ra. Để khử mùi tanh của cá, người ta thường dùng dung dịch:
Mùi tanh cá gây ra bởi các amine (các chất có tính base) như trimetylamin, ta có thể sử dụng chất có tính acid như giấm hoặc chanh. Giấm và chanh đều chứa acid yếu sẽ tạo muối với amine và bị rửa trôi bằng nước, mà không ảnh hưởng nhiều đến chất lượng cá.
Phương trình hóa học giữa trimetylamin và acetic acid (trong giấm ăn):
(CH3)3N + CH3COOH → (CH3)3NHOOCCH3
Chất không có phản ứng với aniline C6H5NH2 là
C6H5NH2 không phản ứng NaOH
Khi cho từ từ methylamine vào ống nghiệm chứa dung dịch copper (II) sulfate thấy
Sơ đồ phản ứng
Methylamine phản ứng với copper (II) sulfate tạo kết tủa copper (II) hydroxide màu xanh lam.
2CH3NH2 + 2H2O + CuSO4 → (CH3NH3)2SO4 + Cu(OH)2↓
Sau kết tủa tan, tạo thành dung dịch màu xanh lam.
Dung dịch methylamine hoà tan được kết tủa Cu(OH)2, tạo thành dung dịch có màu xanh lam là phức chất của methylamine với Cu2+.
4CH3NH2 + Cu(OH)2 → [Cu(CH3NH2)4](OH)2
Khi đốt cháy hoàn toàn một amine đơn chức X, thu được 1,4874 lít khí CO2, 0,2479 lít khí N2 (đkc) và 1,62 gam H2O. Công thức của X là
Công thức tổng quát của amine đơn chức là CxHyN
nCO2 = 1,4874 : 24,79 = 0,06 mol
nC = 0,06 mol
nH2O = 1,62 : 18 = 0,09 mol nH = 0,09.2 = 0,18 mol
nN2 = 0,2479 : 24,79 = 0,01 mol nX = nN = 0,02 mol
Bảo toàn nguyên tố C:
0,02.x = 0,06 x = 3
Bảo toàn nguyên tố H
0,02.y = 0,18 y = 9
Vậy công thức của X là: C3H9N
Trung hòa hoàn toàn 14,4 gam một amine (bậc một, mạch carbon không phân nhánh) bằng acid HCl, tạo ra 31,92 gam muối. Amine có công thức là
Nhận thấy các đáp án đều là amine hai chức do đó ta có công thức tổng quát: R(NH2)2
Phương trình phản ứng tổng quát
R(NH2)2 + 2HCl R(NH3Cl)2
Áp dụng bảo toàn khối lượng:
mHCl = m muối – mamine = 31,92 – 14,4 = 17,52 gam
nHCl = 17,52 : 36,5 = 0,48 mol
Theo phương trình:
mamine = .nHCl = 0,48:2 = 0,24 mol
Mamine = 14,4 : 0,24 = 60 gam/mol
R + 16.2 = 60
R = 28 (C2H4)
Vậy công thức của amine là C2H4(NH2)2
Cho 12 gam hỗn hợp hai amine no, đơn chức, mạch hở tác dụng vừa đủ với V mL dung dịch HCl 1M thu được dung dịch chứa 19,008 gam hỗn hợp muối. Giá trị của V là
Bảo toàn khối lượng ta có:
mamine + mHCl = mmuối
⇒ mHCl = 19,008 – 12 = 7,008 (g)
⇒ nHCl = 7,008:36,5 = 0,192 (mol)
⇒ VHCl = n : V = 0,192 : 1 = 0,192 (lít) = 192 (mL)
Chia một amine bậc một đơn chức thành hai phần bằng nhau. Hoà tan hoàn toàn phần một trong nước rồi cho tác dụng với dung dịch FeCl3 dư. Lọc kết tủa sinh ra rửa sạch, sấy khô, nung đến khối lượng không đổi thu được 1,92 gam chất rắn. Cho phần hai tác dụng với dung dịch HCl dư, sinh ra 4,86 gam muối. Công thức của amine là:
Gọi công thức của amin bậc một đơn chức có công thức RNH2
Chú ý RNH2 có tính base tương tự như NH3
3RNH2 + FeCl3 + 3H2O → Fe(OH)3 ↓ + 3RNH3Cl
2Fe(OH)3 Fe2O3 + 3H2O
Rắn thu được chính là Fe2O3
nFe2O3 = 0,012 mol
Luôn có nFe(OH)3 = 2nFe2O3 = 2. 0,012 = 0,024 mol
⇒ nRNH2 = 0,072 mol
Phương trình tổng quát
RNH2 + HCl → RNH3Cl
Khi tham gia phản ứng trung hòa amine bằng HCl có
nRNH3Cl = namine = 0,072 mol
⇒ MRNH3Cl = 4,86: 0,072 = 67,5 gam/mol
⇒ R = 15 (CH3)
Vậy công thức của amine là CH3NH2.
Cho 11,16 gam một alkylamine X tác dụng với dung dịch FeCl3 dư thu được 12,84 gam kết tủa. Công thức cấu tạo của X là.
nFe(OH)3 = 12,84: 107 = 0,12 (mol)
Gọi công thức của alkylamine là: CnH2n+1NH2
3CnH2n+1NH2 + FeCl3 + 3H2O → 3CnH2n+1NH3Cl + Fe(OH)3↓
0,36 ← 0,12 (mol)
MCnH2n+1NH2 = 11,16 : 0,36 = 31 (g/mol)
⇒ 14n + 17 = 31
⇒ n = 1
⇒ Công thức là CH3NH2
