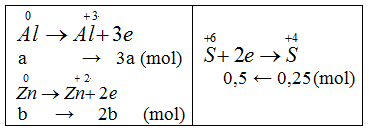Hệ số cân bằng (nguyên, tối giản) của Cu2S và HNO3 trong phản ứng:
Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO + H2O là
Xác định sự thay đổi số oxi hóa
(Cu2S)0 + HN+5O3 → Cu(NO3)2 + H2S+6O4 + N+2O + H2O
Quá trình oxi hóa, quá trình khử
|
3x 10x |
(Cu2S)0 → 2Cu+2 + S+6 + 10e N+5 +3e → N+2 |
3Cu2S + 10N+5→ 6Cu+2+ 3S+6 + 10N+2
3Cu2S + 22HNO3 → 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O
Hệ số cân bằng (nguyên, tối giản) của Cu2S và HNO3 trong phản ứng là 2 và 22