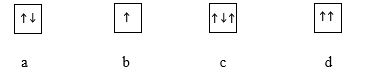
Oxide của kim loại M (M2O) được ứng dụng rất nhiều trong ngành hóa chất như sản xuất xi măng, sản xuất phân bón, … Trong sản xuất phân bón, chúng ta thường thấy M2O có màu trắng, tan nhiều trong nước và là thành phần không thể thiếu cho mọi loại cây trồng. Tổng số hạt cơ bản trong phân tử X có công thức M2O là 140, trong phân tử X có tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44. Xác định công thức phân tử của M2O.
Hướng dẫn:
Trong X có 2 nguyên tử M và 1 nguyên tử O.
Nguyên tử O có pO = 8 và nO = 8
Tổng số hạt cơ bản trong phân tử X có công thức M2O là 140 nên:
4pM + 2nM + 2pO + nO = 140 hay 4pM + 2nM = 116 (1)
Trong phân tử X có tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44 nên:
(4pM + 2pO) – ( 2nM + nO) = 44 hay 4pM – 2nM = 36 (2)
Từ (1) và (2) có pM = 19 và nM = 20.
Vậy M là K (potassium); X là K2O.
nguyên tử zinc