Nguyên tố hóa học
I. Nguyên tố hóa học
1. Khái niệm nguyên tố hóa học
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số hạt proton.
Ví dụ: Ba loại nguyên tử trong hình dưới đây đều có một proton (hạt màu xanh) trong hạt nhân nên thuộc cùng một nguyên tố hóa học, nguyên tố hydrogen (H).
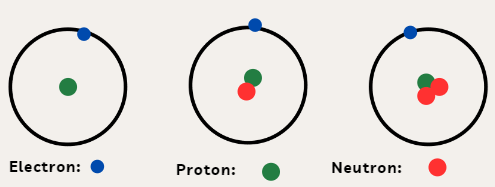
Minh họa cấu tạo một số loại nguyên tử của nguyên tố hydrogen
2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
Số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử, kí hiệu là Z.
Ví dụ: Hạt nhân nguyên tử lithium (Li) có 3 proton, vậy số hiệu nguyên tử của Li là 3 (ZLi = 3).
Tổng số proton (Z) và neutron (N) trong một hạt nhân nguyên tử được gọi là số khối, kí hiệu là A.
A = Z + N
Như vậy, số khối chính bằng tổng số hạt có trong hạt nhân nguyên tử. Giá trị này xấp xỉ bằng giá trị khối lượng nguyên tử (tính theo đơn vị amu).
Ví dụ: Một loại nguyên tử sodium (Na) có 11 hạt proton, 11 electron và 12 hạt neutron. Số khối của nguyên tử Na = Z + N = P + N = 11 + 12 = 23 (amu)
Kí hiệu nguyên tử ![]() cho biết kí hiệu hóa học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).
cho biết kí hiệu hóa học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).
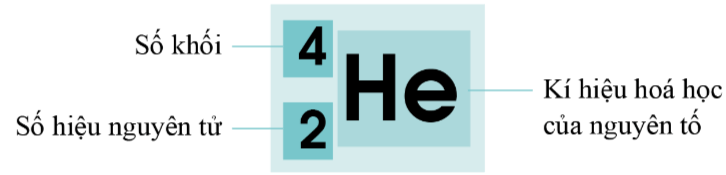
Kí hiệu nguyên tử của helium
Lưu ý: Đôi khi, người ta viết tắt kí hiệu nguyên tử.
Ví dụ: Sử dụng 4He thay cho ![]() , bởi kí hiệu He đã cho biết đây là nguyên tử nguyên tố helium, hạt nhân có 2 proton.
, bởi kí hiệu He đã cho biết đây là nguyên tử nguyên tố helium, hạt nhân có 2 proton.
II. Đồng vị, nguyên tử khối trung bình
1. Đồng vị
Các nguyên tử của cùng một nguyên tố hóa học có số neutron khác nhau là đồng vị của nhau.
Do đó, đồng vị của cùng một nguyên tố hóa học (có cùng số proton) khác nhau về số khối do đó số neutron khác nhau.
Ví dụ: Helium có hai đồng vị bền là ![]() và
và ![]() .
.

Minh họa cấu tạo nguyên tử hai đồng vị của nguyên tố helium
Tất cả các nguyên tố hóa học đều có nhiều đồng vị.
Ví dụ: Hydrogen có 3 đồng vị, ![]() (kí hiệu là P),
(kí hiệu là P), ![]() (kí hiệu là D),
(kí hiệu là D), ![]() (kí hiệu là T), oxygen có 17 đồng vị bắt đầu từ 128O và kết thúc là 288O, ...
(kí hiệu là T), oxygen có 17 đồng vị bắt đầu từ 128O và kết thúc là 288O, ...
2. Nguyên tử khối trung bình
2.1. Nguyên tử khối
Nguyên tử khối là khối lượng tương đối của một nguyên tử, cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần 1 amu.
Ví dụ: Nguyên tử khối của 16O là 16 do khối lượng của một nguyên tử 16O là 16 amu.
2.2. Nguyên tử khối trung bình
Mỗi nguyên tố hóa học đều có nhiều đồng vị.
Trong tự nhiên, một nguyên tố hóa học dù ở dạng đơn chất hay hợp chất thì tỉ lệ giữa các đồng vị của nguyên tố này là không đổi.
Nguyên tử khối của nguyên tố hóa học có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị (kí hiệu là ![]() ), có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng (xác định từ phổ khối lượng).
), có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng (xác định từ phổ khối lượng).
Công thức tính nguyên tử khối trung bình như sau:
![]()
Trong đó:
- X, Y, Z, ... lần lượt là số khối của các đồng vị.
- x, y, z, ... là phần trăm số nguyên tử các đồng vị tương ứng.
Ví dụ: Trong tự nhiên, đồng có hai đồng vị bền là 63Cu và 65Cu chiếm tương ứng khoảng 73% và 27% về số nguyên tử. Nguyên tử khối trung bình của đồng là:
![]()
Lưu ý: Nguyên tử khối của một nguyên tố hóa học ghi trong bảng tuần hoàn là nguyên tử khối trung bình của các đồng vị trong tự nhiên.
-
Chủ đề 1. Cấu tạo nguyên tử
-
Chủ đề 2. Bảng tuần hoàn các nguyên tố hóa học
-
Đề thi giữa học kì 1
-
Chủ đề 3. Liên kết hóa học
-
Đề thi cuối học kì 1
-
Chủ đề 4. Phản ứng Oxi hóa - khử
-
Chủ đề 5. Năng lượng hóa học
-
Đề thi giữa học kì 2
-
Chủ đề 6. Tốc độ phản ứng hóa học
-
Chủ đề 7. Nguyên tố nhóm VIIA (Nhóm Halogen)
-
Đề thi cuối học kì 2







