Lớp L có số phân lớp electron bằng
Số phân lớp trong mỗi lớp bằng số thứ tự của lớp (n ≤ 4)
Phân lớp L (n = 2) có 2 phân lớp là 2s và 2p
Lớp L có số phân lớp electron bằng
Số phân lớp trong mỗi lớp bằng số thứ tự của lớp (n ≤ 4)
Phân lớp L (n = 2) có 2 phân lớp là 2s và 2p
Hình dưới đây cho biết hình dạng của orbital
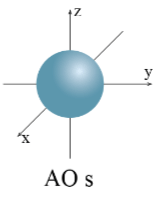
AO hình cầu, còn gọi là AO s;
AO hình số tám nổi, còn gọi là AO p (tùy theo vị trí của AO p trên hệ trục tọa độ Đề - các, sẽ gọi là AO px, py và pz).
Số orbital trong các phân lớp s, p, d lần lượt bằng
Phân lớp s có 1 AO
Phân lớp p có 3 AO
Phân lớp d có 5 AO.
Orbital nguyên tử (kí hiệu là AO) là
Orbital nguyên tử (kí hiệu là AO) làkhu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
Theo mô hình nguyên tử hiện đại, xác suất tìm thấy electron lớn nhất là ở
Theo mô hình nguyên tử hiện đại, xác suất tìm thấy electron lớn nhất là ở trong các orbital nguyên tử (xác suất tìm thấy khoảng 90%).
Nguyên tử F có 9 electron. Theo mô hình Rutherford – Bohr, tỉ lệ số lượng electron trên lớp thứ hai so với số lượng electron trên lớp thứ nhất là
Số lượng electron tối đa trên một lớp là 2.n2 (với n ≤ 4).
Lớp thứ nhất của F chứa tối đa 2 electron.
Lớp thứ hai của F chứa 7 electron (lớp thứ hai tối đa chứa 2.22 = 8 electron).
Vậy tỉ lệ số lượng electron trên lớp thứ hai so với số lượng electron trên lớp thứ nhất là 7 : 2.
Khi nói về mô hình Rutherford – Bohr phát biểu nào sau đây không đúng?
Phát biểu Electron trên lớp K có năng lượng cao hơn trên lớp L sai vì: Electron trên lớp K có năng lượng thấp hơn trên lớp L.
Số electron tối đa ở lớp thứ n (n ≤ 4) là
Số electron tối đa ở lớp thứ n (n ≤ 4) là 2n2
Ví dụ: Số electron tối đa ở lớp thứ tư (n = 4) là 2.42 = 32
Lớp L có số phân lớp electron bằng
Số phân lớp trong mỗi lớp bằng số thứ tự của lớp (n ≤ 4)
Phân lớp L (n = 2) có 2 phân lớp là 2s và 2p
Nếu 5 electron được điền vào 3 AO thì số lượng electron độc thân là
Mỗi AO chứa tối đa 2 electron.
Nếu 5 electron được điền vào 3 AO thì sẽ có 2 AO đã chứa đủ electron tối đa, 1 AO chỉ chứa 1 electron (electron độc thân).
Nguyên tử Cl có 17 electron. Theo mô hình Rutherford – Bohr, nguyên tử Cl có số electron có cùng năng lượng ở lớp thứ nhất là
Cl có số electron tối đa ở lớp thứ nhất là: 2.
Lớp L có tối đa số electron là
Phân lớp K chứa tối đa 2 electron;
Phân lớp L chứa tối đa 8 electron,
Phân lớp M chứa tối đa 18 electron;
Phân lớp N chứa tối đa 32 electron.
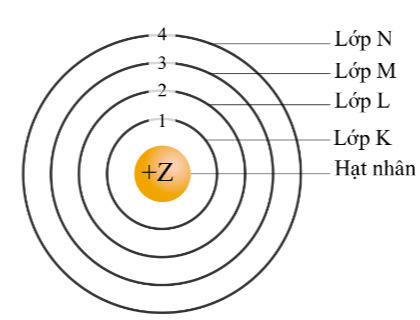
Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của các lớp thứ nhất, thứ hai, thứ ba, thứ tư lần lượt là
Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của các lớp như sau:
Lớp thứ nhất được gọi là lớp K
Lớp thứ hai được gọi là lớp L
Lớp thứ ba được gọi là lớp M
Lớp thứ tư được gọi là lớp N.

Mỗi orbital nguyên tử chứa tối đa
Mỗi orbital nguyên tử chứa tối đa 2 electron có chiều tự quay ngược nhau (nguyên lí loại trừ Pauli).
Dựa vào mô hình nguyên tử Rutherford – Bohr, hãy cho biết phát biểu nào sau đây là đúng.
Số lượng electron tối đa trên các lớp là như nhau ⇒ Sai vì Số electron tối đa trên các lớp là khác nhau, ví dụ lớp thứ nhất có tối đa 2 electron; lớp thứ hai có tối đa 8 electron.
Năng lượng của các electron trên các lớp khác nhau có thể bằng nhau ⇒ sai vì năng lượng của các electron trên các lớp khác nhau là khác nhau.
Electron ở gần hạt nhân nhất có năng lượng cao nhất ⇒ sai vì electron ở gần hạt nhân nhất có năng lượng thấp nhất.
