Phản ứng oxi hóa - khử
Phản ứng oxi hóa - khử đã giới thiệu đến các em lý thuyết về số oxi hóa và phản ứng oxi hóa - khử. Bên cạnh là các ví dụ và bài tập có lời giải chi tiết, xây dựng dựa trên kiến thức trọng tâm chương trình hóa 10 Cánh diều.
I. Số oxi hóa
- Trong các đơn chất, điện tích của nguyên tử luôn bằng 0.
- Trong phân tử, điện tích của nguyên tử nói chung khác 0.
Ví dụ 1: Trong hợp chất ion NaCl, điện tích của Na là 1+ còn của Cl là 1-.
Ví dụ 2: Trong phân tử HCl, điện tích thực của H là δ+ còn Cl là δ-, trong đó 0 < δ < 1 và điện tích này không dễ xác định được.
1. Khái niệm số oxi hóa
Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
Ví dụ:
- Trong các hợp chất ion:
K+Cl-: số oxi hóa của K là +1, của Cl là -1.
Ba2+O2-: số oxi hóa của Ba là +2, của O là -2.
- Trong các hợp chất cộng hóa trị:
H – O – H: với giả định là hợp chất ion, hai cặp electron dùng chung sẽ lệch hoàn toàn về phía nguyên tử O (có độ âm điện lớn hơn), mỗi liên kết đơn có một electron của H bị chuyển sang O nên hợp chất ion giả định là H+O2-H+. Vậy số oxi hóa của H là +1, của O là -2.
2. Cách xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất
Có hai cách để xác định số oxi hóa của các nguyên tử nguyên tố hóa học trong hợp chất.
Cách 1: Dựa theo số oxi hóa của một nguyên tử đã biết và điện tích của phân tử hoặc ion. Theo cách này có hai quy tắc:
Quy tắc 1:
- Số oxi hóa của nguyên tử nguyên tố trong đơn chất bằng 0.
- Trong các hợp chất: Số oxi hóa của H là +1 (trừ một số hydride: NaH, CaH2, ...); Số oxi hóa của O là -2 (trừ một số trường hợp như: OF2, H2O2, ...); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ...) luôn là +1; Số oxi hóa của các kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, ...) luôn là +2; Số oxi hóa của Al luôn là +3.
Quy tắc 2:
Tổng số oxi hóa của các nguyên tử trong phân tử bằng 0, trong một ion đa nguyên tử bằng chính điện tích của ion đó.
Ví dụ 1: Số oxi hóa của các nguyên tố S, Zn, O, Cl trong đơn chất S, Zn, O2, Cl2 đều bằng 0.
Ví dụ 2: Xác định số oxi hóa của N trong NaNO3.
Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có:
1.(+1) + 1.x + 3.(-2) = 0 ⇒ x = +5
Vậy N có số oxi hóa + 5 trong NaNO3.
Ví dụ 3: Xác định số oxi hóa của C trong CO32-.
Gọi x là số oxi hóa của C, theo quy tắc 1 và 2 có:
1.x + 3.(-2) = -2 ⇒ x = +4
Vậy C có số oxi hóa +4 trong CO32-
Cách 2: Dựa theo công thức cấu tạo
Đây là cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
Ví dụ 4: Xác định số oxi hóa của Si và O trong SiO2.
Silicon dioxide (SiO2) có công thức cấu tạo như sau O = Si = O. Trong mỗi liên kết đôi Si = O, một nguyên tử Si góp 2 electron, khi giả định SiO2 là hợp chất ion thì 2 electron này chuyển sang O. Vì có 2 liên kết Si = O nên SiO2 có công thức ion giả định là O2-Si4+O2-. Từ đó xác định được số oxi hóa của O là – 2, của Si là +4.
II. Phản ứng oxi hóa - khử
1. Một số khái niệm
Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của ít nhất một nguyên tố hóa học.
Ví dụ:
(1) ![]()
(2) ![]()
(3) ![]()
Phản ứng (1) là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của Al và H.
Phản ứng (2) là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của Fe và O.
Phản ứng (3) không phải là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng.
Một số khái niệm thường sử dụng đối với phản ứng oxi hóa – khử:
- Chất khử (chất bị oxi hóa) là chất nhường electron.
Ví dụ: Fe trong phản ứng (2).
- Chất oxi hóa (chất bị khử) là chất nhận electron.
Ví dụ: O2 trong phản ứng (2).
- Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron.
Ví dụ: quá trình Al nhường electron trong phản ứng (2).
- Quá trình khử (sự khử) là quá trình nhận electron.
Ví dụ: quá trình O2 nhận electron trong phản ứng (2).
2. Cân bằng phản ứng oxi hóa – khử theo phương pháp thăng bằng electron
Cân bằng các phản ứng oxi hóa - khử theo nguyên tắc: Trong một phản ứng, tổng số electron nhường bằng tổng số electron nhận.
Ví dụ 1: Cân bằng phản ứng:
Cu + AgNO3 ![]() Cu(NO3)2 + Ag
Cu(NO3)2 + Ag
Bước 1: Xác định sự thay đổi số oxi hóa trước và sau phản ứng của các nguyên tử:
![]()
![]()
![]()
Bước 2: Viết các quá trình oxi hóa và quá trình khử
![]() (1)
(1)
![]() (2)
(2)
Bước 3: Thăng bằng electron bằng cách nhân thêm hệ số vào các quá trình nhường và nhận electron sao cho tổng số electron nhường bằng tổng số electron nhận. Cộng các quá trình (đã nhân hệ số) với nhau sẽ thu được sơ đồ (3).
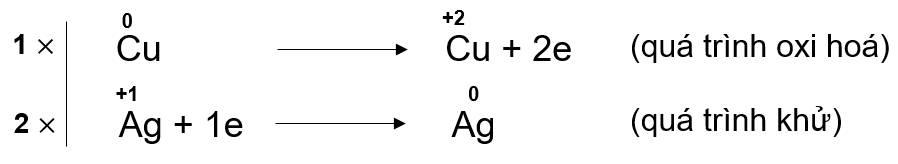
![]()
![]()
![]()
Bước 4: Dựa vào sơ đồ trên để hoàn thành phương trình dạng phân tử.
Cu + 2AgNO3 ![]() Cu(NO3)2 + 2Ag
Cu(NO3)2 + 2Ag
Ví dụ 2: Cân bằng phản ứng:
Cu + HNO3 ![]() Cu(NO3)2 + NO2 + H2O
Cu(NO3)2 + NO2 + H2O
Bước 1: ![]()
![]()
![]()
Bước 2:
![]() (1)
(1)
![]() (2)
(2)
Bước 3:
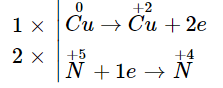
![]()
![]()
3. Ý nghĩa của một số phản ứng oxi hoá - khử quan trọng
1. Phản ứng liên quan đến việc cung cấp năng lượng
Quá trình oxi hóa các phân tử thường giải phóng một lượng lớn năng lượng.
- Phản ứng đốt cháy than, củi sinh ra năng lượng dưới dạng nhiệt nên được con người ứng dụng để sưởi ấm, nấu nướng, ...

C + O2 ![]() CO2
CO2
⇒ Phản ứng toả năng lượng.
- Các hoạt động của cơ thể đều cần năng lượng, sự hô hấp đã cung cấp oxygen để oxi hóa các chất, chẳng hạn đường glucose, sinh ra năng lượng:
C6H12O6 + O2 → 6CO2 + 6H2O
2. Phản ứng liên quan đến việc lưu trữ năng lượng
- Pin lithium – ion trong điện thoại, máy tính cũng như acquy trong ô tô, xe máy có thể dự trữ năng lượng dưới dạng điện năng dựa vào các phản ứng oxi hóa – khử.

- Phản ứng quang hợp cũng là một trong những phản ứng oxi – hóa khử quan trọng nhất trên Trái Đất, năng lượng được lấy từ ánh sáng mặt trời và tích trữ trong tinh bột.
6CO2 + 6H2O ![]() C6H12O6 + 6O2
C6H12O6 + 6O2
- Bên cạnh những phản ứng oxi hóa – khử quan trọng, có ích lợi đối với con người, còn có một loại phản ứng oxi hóa – khử diễn ra ngoài ý muốn.
Ví dụ: Phản ứng ăn mòn kim loại như tạo gỉ sắt, phản ứng oxi hóa trong thức ăn làm thức ăn bị ôi thiu, cháy rừng, …







