Tốc độ phản ứng hóa học
Bài học: Tốc độ hóa học đã giới thiệu đến các em lý thuyết về tốc độ phản ứng, định luật tác dụng khối lượng và các yếu tố ảnh hưởng đến tốc độ phản ứng. Bên cạnh là các ví dụ và bài tập có lời giải chi tiết, xây dựng dựa trên kiến thức trọng tâm chương trình hóa 10 Cánh diều.
I. Khái niệm tốc độ phản ứng, tốc độ trung bình của phản ứng.
1. Khái niệm tốc độ phản ứng
Thí nghiệm: Cho hai mảnh Mg có cùng khối lượng vào hai ống nghiệm chứa cùng thể tích dung dịch HCl dư, nồng độ dung dịch HCl ở mỗi ống nghiệm lần lượt là 2M (thí nghiệm (a)) và 0,5M (thí nghiệm (b)):
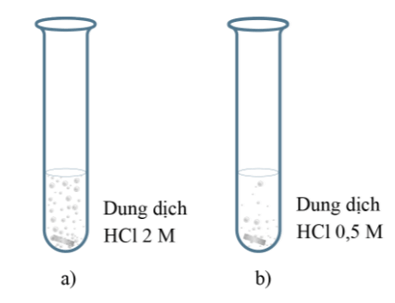
Hình 1: Hòa tan mảnh Mg trong hai dung dịch HCl có nồng độ khác nhau
Phản ứng xảy ra trong thí nghiệm:
Mg(s) + 2HCl(aq) ![]() MgCl2(aq) + H2(g)
MgCl2(aq) + H2(g)
Hiện tượng: bọt khí H2 thoát ra ở thí nghiệm (a) nhanh hơn so với thí nghiệm (b) đã chứng tỏ lượng HCl bị mất đi do phản ứng với Mg ở thí nghiệm (a) nhanh hơn ở thí nghiệm (b).
Kết luận: Tốc độ phản ứng giữa Mg với dung dịch HCl ở các nồng độ khác nhau là khác nhau.
- Khái niệm: Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
- Tốc độ phản ứng được kí hiệu là v, có đơn vị là: (đơn vị nồng độ) (đơn vị thời gian)-1.
Ví dụ: mol.L-1 (hay Ms-1),...
2. Tốc độ trung bình của phản ứng
Tốc độ trung bình của phản ứng (![]() ) là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
) là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
Phản ứng tổng quát:
aA + bB → mM + nN (1)
Tốc độ phản ứng (1) được tính dựa theo sự thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước sau:![]()
Trong đó: ![]() = C2 - C1,
= C2 - C1, ![]() = t2 - t1 lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng. C1, C2 là nồng độ của một chất tại thời điểm tương ứng t1 và t2 (với t2 > t1).
= t2 - t1 lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng. C1, C2 là nồng độ của một chất tại thời điểm tương ứng t1 và t2 (với t2 > t1).
Ví dụ: Cho phản ứng phân hủy N2O5:
2N2O5(g) ![]() 4NO2(g) + O2(g)
4NO2(g) + O2(g)
Nồng độ của mỗi chất trong phản ứng (3) tại thời điểm t1 = 0 và t2 = 50s được cho trong bảng sau:
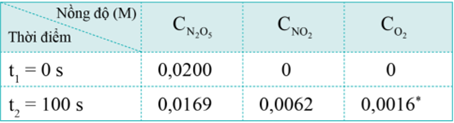
Tốc độ trung bình của phản ứng có thể được tính theo biến thiên nồng độ chất phản ứng hoặc sản phẩm:
- Tính theo nồng độ N2O5: Nồng độ của N2O5 ban đầu (C1) là 0,0200M, sau 100s (C2) là 0,0169M.
![]() Tốc độ trung bình của phản ứng trong 100s đầu tiên là:
Tốc độ trung bình của phản ứng trong 100s đầu tiên là:
![]()
- Tính theo NO2: Nồng độ của NO2 ban đầu (C1) là 0M, sau 100s (C2) là 0,0062M
![]() Tốc độ trung bình của phản ứng trong 100s đầu tiên là:
Tốc độ trung bình của phản ứng trong 100s đầu tiên là:
![]()
II. Định luật tác dụng khối lượng
Thí nghiệm: Cho hai mảnh Zn có cùng khối lượng vào hai ống nghiệm chứa cùng thể tích dung dịch H2SO4 loãng, dư, nồng độ dung dịch ở mỗi ống nghiệm lần lượt là 0,5M và 1M.

Hình 2. Minh họa mô hình Zn trong dung dịch H2SO4 loãng
Giải thích: Để phản ứng xảy ra, cần phải có sự va chạm giữa H2SO4 và Zn. Nồng độ của H2SO4 ở ống nghiệm (b) lớn gấp đôi nồng độ H2SO4 ở ống nghiệm (a), do vậy số va chạm của H2SO4 với Zn trong ống nghiệm (b) sẽ nhiều hơn, dẫn đến tốc độ phản ứng ở ống nghiệm (b) là lớn hơn.
Kết luận: Khi nồng độ chất tham gia phản ứng càng lớn thì tốc độ phản ứng càng lớn.
Giải thích: Để phản ứng xảy ra, các phân tử phản ứng phải va chạm với nhau, nồng độ càng lớn thì số lượng va chạm càng nhiều (trong cùng một đơn vị thời gian, một đơn vị thể tích) nên tốc độ phản ứng càng lớn.
- Định luật tác dụng khối lượng áp dụng cho các phản ứng đơn giản, biểu thị sự phụ thuộc tốc độ phản ứng theo nồng độ các chất phản ứng.
Phản ứng tổng quát:
aA + bB →sản phẩm
Tốc độ phản ứng được tính như sau: ![]()
![]()
Trong đó: CA, CB là nồng độ mol L-1 tương ứng của chất A và B; k là hằng số tốc độ phản ứng mà giá trị của nó chỉ phụ thuộc vào nhiệt độ và bản chất các chất tham gia phản ứng.
- Định luật tác dụng khối lượng: Tốc độ phản ứng tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
- Hằng số tốc độ phản ứng càng lớn thì tốc độ phản ứng càng lớn.
- Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1M. Đây chính là ý nghĩa của hằng số tốc độ phản ứng.
Ví dụ: Phản ứng của H2 và Br2 là phản ứng đơn giản:
H2(g) + Br2(g) ![]() 2HBr(g) (2)
2HBr(g) (2)
Theo định luật tác dụng khối lượng, tốc độ của phản ứng (2) được viết dưới dạng:
![]() = k.CH2.CBr2
= k.CH2.CBr2
Ở một nhiệt độ không đổi, tốc độ phản ứng trên, tốc độ phản ứng (2) tỉ lệ với nồng độ của H2, cũng như nồng độ của Br2.
III. Các yếu tố ảnh hưởng tới tốc độ phản ứng, hệ số nhiệt độ Van’t Hoff
1. Ảnh hưởng của nồng độ
Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn.
Ví dụ: Phản ứng của H2 và I2 như sau:
H2(g) + Br2(g) ![]() 2HBr(g)
2HBr(g)
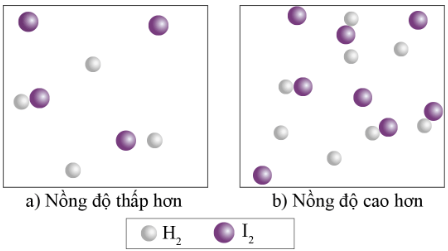 Hình 3: Minh họa ảnh hưởng của nồng độ các chất phản ứng tới tốc độ phản ứng
Hình 3: Minh họa ảnh hưởng của nồng độ các chất phản ứng tới tốc độ phản ứng
Khi nồng độ của H2 và I2 tăng lên trong một đơn vị thể tích, các phân tử này cũng sẽ nhiều hơn, dẫn đến số lượng va chạm giữa chúng (trong cùng một đơn vị thời gian) tăng lên. Vì vậy tốc độ phản ứng tăng lên khi nồng độ các chất tăng.
2. Ảnh hưởng của áp suất
Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng càng lớn.
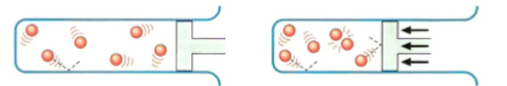
a) áp suất thấp hơn b) áp suất cao hơn
Hình 4: Minh họa ảnh hưởng của áp suất các chất phản ứng tới tốc độ phản ứng
Đối với các chất khí, nồng độ của chất khí tỉ lệ với áp suất của nó. Do vậy, khi áp suất chất tham gia phản ứng ở thể khí tăng lên, sẽ làm nồng độ chất khí tăng lên, từ đó làm tốc độ phản ứng tăng.
Ví dụ: Phản ứng tổng hợp NH3 từ N2 và H2 được thực hiện ở áp suất rất cao từ 200 – 300 atm để tăng tốc độ phản ứng.
3. Ảnh hưởng của diện tích bề mặt
Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn.
Ví dụ: Cần nghiền mịn đá vôi khi trộn với đất sét để tăng tốc độ phản ứng tạo nguyên liệu làm xi măng.
4. Ảnh hưởng của nhiệt độ
Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị ![]() = 2 ÷ 4 này được gọi là hệ số nhiệt độ Van’t Hoff.
= 2 ÷ 4 này được gọi là hệ số nhiệt độ Van’t Hoff.
Mối liên hệ của hệ số nhiệt độ Van’t Hoff tới tốc độ và nhiệt độ như sau:
![]()
Trong đó, ![]() và
và ![]() là tốc độ phản ứng ở nhiệt độ T2 và T1 tương ứng.
là tốc độ phản ứng ở nhiệt độ T2 và T1 tương ứng.
Ví dụ: Nước nhanh sôi hơn khi được đun ở nhiệt độ cao; thức ăn bị chậm ôi, thiu khi được để trong tủ lạnh, ...
5. Ảnh hưởng của chất xúc tác
Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị thay đổi cả về lượng và chất sau phản ứng.
Ví dụ: Dung dịch H2O2 3% ở điều kiện bình thường phân hủy rất chậm theo phương trình:
2H2O2(aq) ![]() O2(g) + 2H2O(l)
O2(g) + 2H2O(l)
Tuy nhiên tốc độ phản ứng phân hủy này sẽ nhanh hơn rất nhiều khi có mặt chất xúc tác MnO2. Kết thúc thí nghiệm trên, màu đen của MnO2 ban đầu vẫn giữ nguyên vì MnO2 không bị biến đổi sau phản ứng phân hủy H2O2.
Ví dụ:
Phản ứng tổng hợp NH3 từ N2 và H2 cần sử dụng chất xúc tác là sắt kim loại được trộn thêm Al2O3, K2O, ... để làm tăng tốc độ phản ứng, phản ứng không có chất xúc tác sẽ diễn ra rất chậm.
Các enzyme trong cơ thể là những chất xúc tác sinh học thúc đẩy các phản ứng sinh hóa phức tạp trong cơ thể chúng ta. Ví dụ: enzyme amylase có trong nước ngọt giúp thủy phân tinh bột thành đường.







