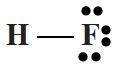Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s – s?
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
Liên kết trong phân tử H2 được hình thành nhờ sự xem phủ orbital s – s.
Liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
Liên kết trong phân tử NH3 được hình thành bởi sự xen phủ orbital s – p.
Liên kết trong phân tử HCl được hình thành bởi sự xen phủ orbital s – p