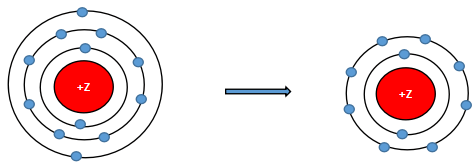
Nguyên tử X có điện tích hạt nhân là +19. Khi hình thành liên kết hóa học X có xu hướng
Nguyên tử X có điện tích hạt nhân là +19
⇒ ZX = 19
⇒ Cấu hình electron: 1s22s22p63s23p64s1
⇒ Có 1 elctron lớp ngoài cùng ⇒ xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm.